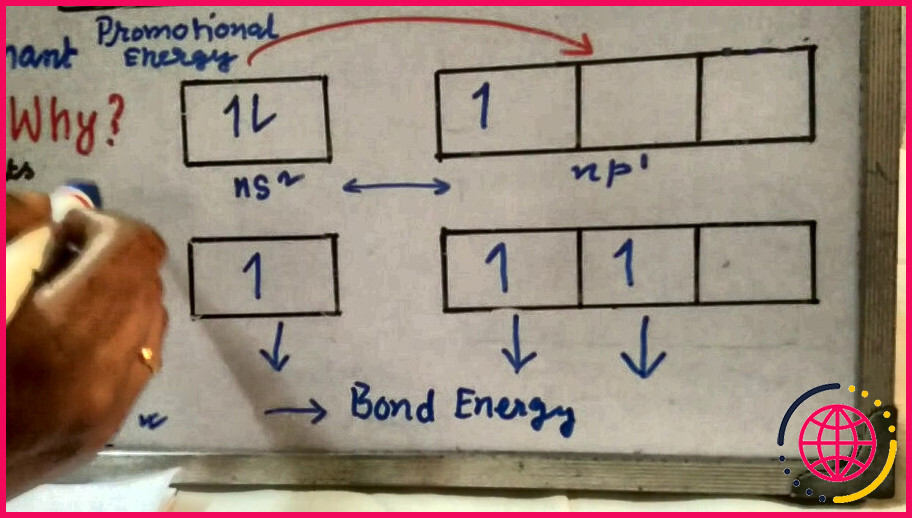
Qu’est-ce que l’effet de paire inerte avec exemple ?
L’ effet de paire inerte est défini comme la tendance des électrons de l’orbitale s atomique la plus externe à rester unis dans les composés des métaux post-transition [1]. Pour simplifier, résumons-le comme la tendance des atomes les plus lourds à former des ions avec une différence de charge de deux. Un exemple est l’hélium, avec deux électrons.
Par ailleurs, que signifie l’effet de paire inerte ?
L’ effet de paire inerte est la tendance des deux électrons de l’orbitale s atomique la plus externe à rester unis ou non partagés dans les composés des métaux post-transition.
Deuxièmement, qu’est-ce que l’effet de paire inerte dans les éléments du bloc P ? L’effet de paire inerte décrit la préférence des éléments du bloc p – tardif ( éléments du 3ème au 6ème groupe principal, à partir de la 4ème période mais devenant vraiment important pour les éléments à partir de la 6ème période) à former des ions dont l’état d’oxydation est 2 de moins que la valence du groupe.
De même, on se demande quelle est la raison de l’effet de paire inerte ?
L’effet de paire inerte est surtout montré par les éléments des groupes 15-17. C’est-à-dire que l’état d’oxydation se réduit de 2 pour les éléments inférieurs à (As, Sb), ce qui est plus stable que les autres états d’oxydation. La raison de ce phénomène est l’inertage des électrons s internes dû à un mauvais blindage.
Dans quels éléments trouve-t-on l’effet de paire inerte ?
L’effet de paire inerte est le nom donné à la tendance des électrons présents dans la sous-coquille s la plus externe des métaux post-transition, comme Pb, Bi etc. à ne pas subir d’ionisation, et à rester non partagés. Ce phénomène est le plus marqué dans les groupes 13, 14 et 15.
Qu’est-ce qu’un mauvais effet de blindage ?
C’est ce qu’on appelle l’effet de bouclier ou l’effet de écran . On dit que les orbitales d et f présentent un pauvre effet d’écran . Poor shielding signifie mauvais blindage de la charge nucléaire. En d’autres termes, la charge nucléaire n’est pas efficacement blindée par les électrons en question. L’ effet d’écran des différentes orbitales est le suivant : ?
Qui ne montre pas d’effet de paire inerte ?
Hence, en raison de sa petite taille et de l’absence d’orbitales d et f, l’aluminium ne présente pas d’effet de paire inerte .
L’effet d’écran et l’effet de blindage sont-ils identiques ?
L’effet d’écran est la réduction de la charge nucléaire effective sur le nuage d’électrons, en raison des différences dans les forces d’attraction entre les électrons et le noyau. L’ effet d’écran est également connu sous le nom de effet d’écran . Dès lors, il n’y a pas de différence entre ces deux termes. Ils signifient principalement la même chose.
L’effet de paire inerte et l’effet de blindage sont-ils identiques ?
Réponse : L’effet de paire inerte se produit en raison de la tendance de l’orbitale s extérieure à ne pas prendre part à la liaison. Effet d’écran :Si l’électron est dans l’orbitale s, cela signifie qu’il est le plus proche du noyau et s’il est dans la coquille f, cela signifie qu’il est le plus loin du noyau.
Quelle est la conséquence de l’effet de paire inerte ?
Explication : L’effet de paire inerte est surtout montré par les éléments du 15-17ème groupe. C’est-à-dire que l’état d’oxydation se réduit de 2 pour les éléments inférieurs à (As, Sb), ce qui est plus stable que les autres états d’oxydation. Cela s’explique par l’inertie des électrons s internes due à un mauvais blindage.
Qu’est-ce que l’élément de bloc P ?
Les p – éléments du bloc se trouvent sur le côté droit du tableau périodique. Ils comprennent les familles du bore, du carbone, de l’azote, de l’oxygène et de la flourine, en plus des gaz nobles. Les gaz nobles ont des orbitales p complètes et sont non réactifs. Orbitale complète p .
Pourquoi le pb2+ est plus stable que le pb4+ ?
Réponse : Les éléments non-transitionnels présentent également des états d’oxydation variables. Cependant ceux-ci diffèrent des états d’oxydation variables présentés par les éléments de transition. Dans les éléments non-transitionnels du bloc p, l’état d’oxydation inférieur est plus stable en raison de l’effet de paire inerte, par exemple, Pb2+ est plus stable que Pb4+ .
Pourquoi le sn4+ est-il plus stable que le sn2+ ?
A l’étain, l’état +4 est plus stable que le +2, mais les composés de l’étain(II) sont assez courants. a) Les ions Sn2+ se transforment en ions Sn4+ car l’état d’oxydation de l’étain(IV) est plus stable que l’étain(II). Cela signifie la perte de deux électrons plus des ions étain(II), et ceux-ci doivent être donnés à quelque chose d’autre, qui les gagne.
Pourquoi les orbitales d et f ont-elles un mauvais effet de blindage ?
Si l’électron est dans l’ orbitale s , cela signifie qu’il est le plus proche du noyau et s’il est dans l’orbitale f , cela signifie qu’il est le plus éloigné du noyau. Puisque le blindage atomique
dépend de la densité d’électrons dans une orbitale et la densité d’électrons est très faible pour les orbitales d et f , donc elle a un mauvais effet de blindage par rapport aux orbitales s et p .
Comment trouver l’état d’oxydation ?
Explication:
- Le nombre d’oxydation d’un élément libre est toujours 0.
- Le nombre d’oxydation d’un ion monatomique est égal à la charge de l’ion.
- Le nombre d’oxydation de H est +1, mais il est -1 dans lorsqu’il est combiné avec des éléments moins électronégatifs.
- Le nombre d’oxydation de O dans les composés est habituellement -2, mais il est -1 dans les peroxydes.
Comment l’effet de paire inerte affecte-t-il l’état d’oxydation ?
Effet de paire inerte : C’est la réticence des électrons de l’orbitale s à participer à la liaison dans un atome. Cet effet augmente vers le bas du groupe. Dans le groupe 14, les états d’oxydation généraux présentés par les éléments sont +4,+2. La stabilité du +2 état d’oxydation augmente vers le bas du groupe à cause de l’effet de paire inerte .
Pourquoi l’effet de paire inerte augmente-t-il vers le bas du groupe ?
RÉPONSE. L’ effet de paire inerte est la tendance de deux Electrons dans l’orbitale atomique la plus extérieure à rester non partagés. Les électrons présents dans les orbitales d-(et f-) intermédiaires ne font pas efficacement écran aux électrons s de la coquille de violence en bas du groupe .
Qu’est-ce que la chimie de l’effet d’alternance ?
L’anomalie dans la tendance générale à l’abaissement de l’EN vers le bas du groupe est appelée l’effet alternance et résulte de l’augmentation des charges nucléaires effectives des éléments 4p en raison de la présence de leurs électrons 3d qui font mal écran. (L’effet alternation est également observé dans le groupe 14 où Ge est plus électronégatif que Si.)
Pourquoi l’affinité électronique diminue-t-elle vers le bas d’un groupe ?
Moins un atome a d’ électrons de valence, moins il a de chances de gagner des électrons . L’affinité électronique diminue en bas des groupes et de droite à gauche à travers les périodes du tableau périodique parce que les électrons sont placés dans un niveau d’énergie plus élevé loin du noyau, d’où une diminution de son attraction.
Qu’est-ce que l’état d’oxydation d’un groupe ?
Le plus haut état d’oxydation des éléments du bloc p est numériquement égal au numéro du groupe moins 10 ou nombre d’électrons de valence. Cet état d’oxydation le plus élevé présenté par tous les éléments d’un groupe particulier est appelé état d’oxydation du groupe . Par exemple, pour 13 groupe , le nombre de groupe =13,
.
Pour quel élément l’inertie de la paire d’électrons ne sera pas observée ?
PB. IN. Fe si le élément dans lequel l’effet de la paire inerte n’est pas observé . L’effet de paire inerte est la tendance des électrons de l’orbitale atomique s la plus extérieure à rester syndiqués ou, en d’autres termes, nous pouvons simplement dire que la participation des électrons de l’orbitale atomique s n’est pas là.
Lequel des éléments suivants présente l’effet de paire inerte le plus important ?
Dans le plomb (Pb) l’effet de paire inerte est le plus proéminent car au fur et à mesure que nous passons du carbone au plomb dans le groupe, la tendance à la non-participation des électrons ns internes dans la liaison chimique augmente en raison de la grande taille des atomes.