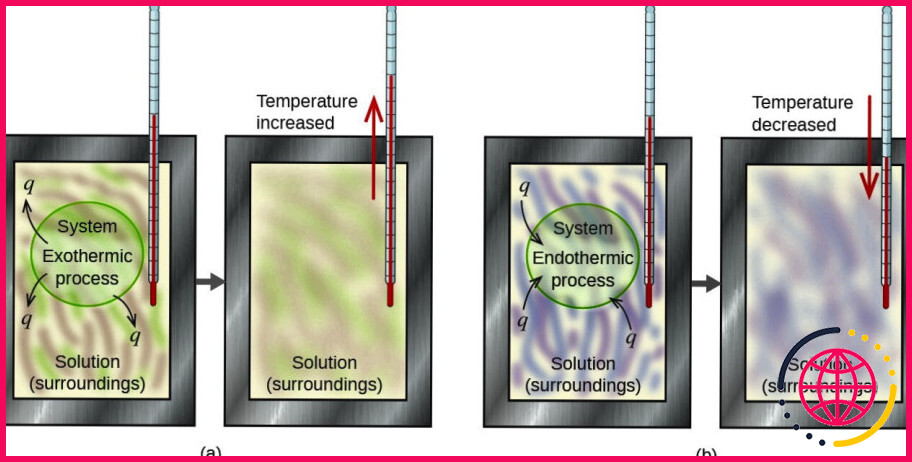
Ce processus de dissolution était-il endothermique ou exothermique ?
Une réaction chimique est endothermique si elle absorbe la chaleur de l’environnement. Les réactions exothermiques dégagent de la chaleur. Le processus de dissolution est généralement exothermique, car le processus de rupture des liaisons solide-liquide nécessite de l’énergie, et cette énergie est libérée sous forme de chaleur.
Le processus de dissolution est exothermique lorsque plus d’énergie est libérée lorsque les molécules d’eau se » lient » au soluté que celle utilisée pour séparer le soluté. Parce que plus d’énergie est libérée que celle utilisée, les molécules de la solution se déplacent plus rapidement, ce qui fait augmenter la température.
La dissolution dans l’eau est-elle endothermique ou exothermique ?
2. Quel processus est endothermique et lequel est exothermique ? La dissolution dans l’eau est un processus exothermique.
La dissolution de NaCl est-elle endothermique ou exothermique ?
Dissolution du NaCl dans l’eauLa dissolution du chlorure de sodium dans l’eau est endothermique.
La fonte de la glace est-elle endothermique ou exothermique ?
Cette énergie brise les liaisons rigides de la glace et fait que les molécules d’eau se déplacent plus rapidement et se heurtent plus souvent. En conséquence, la température de la glace augmente et elle se transforme en eau ! Fondamentalement, la fonte de la glace est une réaction endothermique parce que la glace absorbe de l’énergie (chaleur), ce qui entraîne un changement.
La cuisson d’un œuf est-elle endothermique ou exothermique ?
La réaction endothermique décrite est celle de la cuisson d’un œuf. Dans le processus, la chaleur de la poêle est absorbée par l’œuf, ce qui est le processus de sa cuisson, donc le résultat final est un œuf cuit.
Le nh4cl est-il exothermique ou endothermique ?
La dissolution du chlorure d’ammonium est utilisée pour refroidir un récipient d’eau placé dans la solution. C’est un processus endothermique.
Que se passe-t-il pendant la dissolution ?
Un solvant est la substance qui fait la dissolution – il dissout le soluté. Dans une solution saline, l’eau est le solvant. Pendant la dissolution, les particules de solvant entrent en collision avec les particules de soluté. Elles entourent les particules de soluté, les éloignant progressivement jusqu’à ce que les particules soient uniformément réparties dans le solvant.
Quelles sont les 3 étapes du processus de dissolution ?
Introduction
- Étape 1 : séparer les particules du soluté les unes des autres.
- Étape 2 : Séparer les particules du solvant les unes des autres.
- Étape 3 : Combiner les particules de soluté et de solvant séparées pour obtenir une solution.
Qu’est-ce qui peut se dissoudre ?
Des choses comme le sel, le sucre et le café se dissolvent dans l’eau. Ils sont solubles. Ils se dissolvent généralement plus vite et mieux dans l’eau tiède ou chaude. Le poivre et le sable sont insolubles, ils ne se dissolvent pas même dans l’eau chaude.
Comment pouvez-vous accélérer le processus de dissolution ?
En remuant . Remuer un soluté dans un solvant accélère la vitesse de dissolution car cela aide à distribuer les particules de soluté dans tout le solvant. Par exemple, lorsque vous ajoutez du sucre à un thé glacé et que vous remuez ensuite le thé, le sucre se dissout plus rapidement.
Le na2co3 est-il exothermique ou endothermique ?
Les molécules de carbonate de sodium sont réarrangées dans l’eau, libérant de l’énergie sous forme de chaleur. Ce transfert de chaleur hors d’un système chimique est appelé un processus exothermique.
Quels sont les produits qui utilisent une réaction exothermique ?
8 Exemples de réaction exothermique dans la vie de tous les jours.
- Les glaçons . Lorsque l’eau gèle en glaçons, l’énergie est libérée sous forme de chaleur.
- Formation de la neige dans les nuages. Le processus de formation de la neige est une réaction exothermique.
- Paquets chauds.
- Rouille du fer.
- Brûlage de bougies.
- Foudre d’allumettes.
- Prise du ciment et du béton.
Quel est le pH du NH4Cl ?
-Donc, le pH de la solution de chlorure d’ammonium est de 5,35. -Donc, la bonne option est B. Note : Un acide fort est un acide qui se dissout dans une solution aqueuse et se dissocie complètement en moins de temps. L’exemple d’un acide fort est l’acide chlorhydrique (HCl).
Quel est le pH d’une solution 2.0 M de NH4Cl ?
Le ph de la solution donnée de NH4Cl est de -0,504.
Quel serait le ph d’une solution 0.2 M de NH4Cl ?
Le ph d’une solution 0,02 M de NH4Cl sera :[given Kb(NH4OH) = 10^-5 and log 2 = 0.301].
Le NH4Cl a-t-il un pH élevé ?
La solution aqueuse de chlorure d’ammonium est légèrement acide ayant une valeur de pH comprise entre 4,5 et 6. Le chlorure d’ammonium est un électrolyte fort car il s’est entièrement dissous en ions ou ionisé à 100% dans une solution aqueuse. 1 Pourquoi NH4Cl agit-il comme un sel acide ?
Quels sont 2 exemples de réactions exothermiques ?
Voici quelques exemples de réaction exothermique :
- Fabrication d’un glaçon. La fabrication d’un glaçon est un processus de changement d’état du liquide en solide.
- Formation de neige dans les nuages.
- Brûlage d’une bougie.
- Rouille du fer.
- Brûlage du sucre.
- Formation de paires d’ions.
- Réaction de l’acide fort et de l’eau.
- Eau et chlorure de calcium.
Quel est l’exemple de réaction exothermique ?
Une réaction exothermique est définie comme une réaction qui libère de la chaleur et a un changement d’enthalpie standard négatif net. Les exemples incluent tout processus de combustion, la rouille du fer et la congélation de l’eau. Les réactions exothermiques sont des réactions qui libèrent de l’énergie dans l’environnement sous forme de chaleur.
Quels sont 2 exemples de réactions endothermiques ?
Ces exemples pourraient être écrits comme des réactions chimiques, mais sont plus généralement considérés comme des processus endothermiques ou d’absorption de chaleur :
- La fonte des glaçons.
- Faire fondre des sels solides.
- Evaporation de l’eau liquide.
- Transformation du givre en vapeur d’eau (la fusion, l’ébullition et l’évaporation, en général, sont des processus endothermiques.
Le bicarbonate de soude et le vinaigre sont-ils une réaction exothermique ?
Cette réaction est appelée une réaction exothermique. Dans la partie B de cette activité, du bicarbonate de soude a été ajouté au vinaigre. Le bicarbonate de soude réagit avec le vinaigre pour produire du gaz carbonique, de l’acétate de sodium et de l’eau. Cette réaction est appelée une réaction endothermique.
Le bicarbonate de soude et l’eau sont-ils exothermiques ou endothermiques ?
Endothermique signifie que tu dois mettre de l’énergie (chaleur) pour que la réaction se produise alors qu’exothermique signifie qu’il reste de l’énergie (chaleur). La chaleur restante va augmenter la température. Le bicarbonate de soude et l’eau sont exothermiques et donc l’eau se réchauffe un peu.
Quelle est la formule chimique du détergent ?
Le détergent est un agent émulsifiant que l’on appelle scientifiquement dodécyl benzène sulfonate de sodium et dont la formule chimique est c18h29nao3s.
Quels sont les 3 facteurs qui influencent la vitesse de dissolution ?
La vitesse de dissolution dépend de la surface (soluté à l’état solide), de la température et de la quantité d’agitation.
Pourquoi l’écrasement accélère-t-il la dissolution ?
L’énergie, qui est la capacité à effectuer un travail ou à produire de la chaleur, affecte la vitesse à laquelle un soluté va se dissoudre. Briser, écraser ou broyer un morceau de sucre avant de l’ajouter à l’eau augmente la surface du sucre. Cela signifie que plus les particules de sucre sont fines, plus elles se dissoudront rapidement.
Qu’est-ce qui n’augmente pas la vitesse de dissolution ?
NOTE : L’augmentation de la température et la diminution de la température sont des OPPOSITIONS. Soit ils ont un effet sur le taux, soit ils n’en ont pas. Si elles n’ont aucun effet, elles seraient toutes deux des actions qui n’augmenteraient pas le taux de dissolution d’un solide dans un liquide.