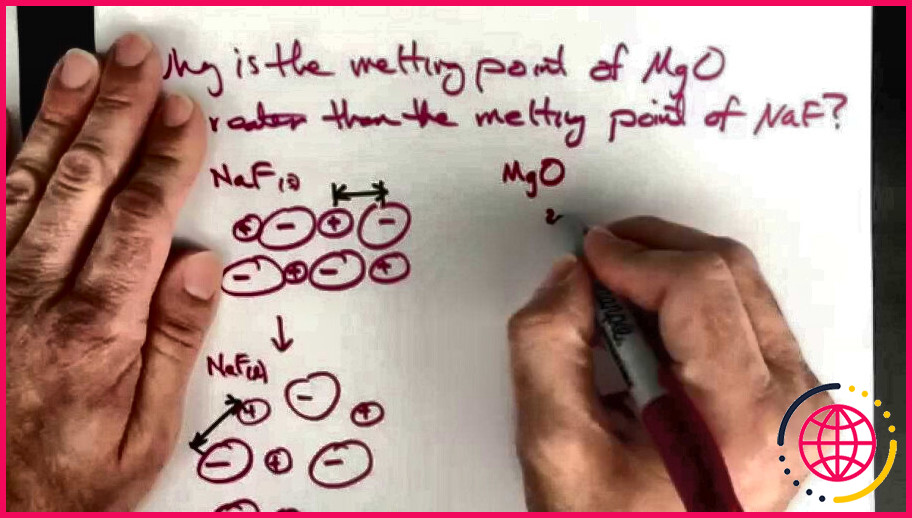
Comment la loi de coulomb se rapporte-t-elle à l’énergie du réseau ?
Plus l’ion est petit, plus la densité de charge est grande. La loi de Coulomb s’intéresse à l’interaction de seulement deux ions. Dans les composés ioniques, nous avons un réseau qui est composé de nombreux ions qui interagissent tous. L’ énergie qui est libérée lors de la formation du réseau à partir d’ions séparés est appelée l’ énergie de réseau .
Donc, comment la charge affecte-t-elle l’énergie de réseau ?
Ce modèle met l’accent sur deux facteurs principaux qui contribuent à l’ énergie de réseau d’un solide ionique : la charge sur les ions, et le rayon, ou la taille, des ions. L’ effet de ces facteurs est le suivant : lorsque la charge des ions augmente, l’ énergie de réseau augmente. lorsque la taille des ions augmente, l’ énergie de réseau diminue.
Sachez également, sur quoi porte la loi de Coulomb ? La loi de Coulomb nous indique comment la force entre les particules chargées est affectée par les charges individuelles et la distance entre elles. La force change en relation directe avec le produit des charges des particules et en relation inverse avec la distance.
De même, on demande comment la loi de Coulomb se rapporte à l’énergie d’ionisation.
L’ énergie d’ionisation d’un atome est la énergie différence entre l’électron lié dans l’atome et l’électron à une distance infinie de l’atome. La loi de Coulomb donne l’énergie potentielle électrique entre deux charges ponctuelles avec la distance r qui les sépare. L’ énergie est inversement proportionnelle à cette distance.
Qu’est-ce que l’énergie de réseau Comment est très avec la charge et la distance des ions ?
L’ énergie de réseau (U) d’une substance ionique est définie comme la énergie nécessaire pour dissocier le solide en ions gazeux ; U peut être calculée à partir des charges sur les ions , de la disposition des ions dans le solide et de la distance internucléaire.
L’électronégativité affecte-t-elle l’énergie du réseau ?
Une petite différence d’ électronégativité signifie que l’attraction vers chaque atome est presque la même, donc l’électron est plus partagé (un caractère covalent). Plus la différence d’ électronégativité est faible, plus le caractère covalent est grand. Plus le caractère covalent est grand, plus l’énergie de réseau est faible .
Quelle est l’énergie de réseau de NaCl ?
Pour NaCl , la énergie de réseau de dissociation enthalpie est de +787 kJ mol–1. Vous devriez parler de » lattice formation enthalpie » si vous voulez parler de la quantité d’ énergie libérée lorsqu’un lattice est formé à partir de ses ions gazeux dispersés. Pour NaCl , la enthalpie de formation du réseau est de -787 kJ mol–1.
Quelle est la tendance de l’énergie de réseau ?
Lorsque le rayon atomique augmente, c’est-à-dire lorsqu’on descend d’une colonne, l’ énergie de réseau diminue. Réseau . énergie augmente avec la charge des ions formant le réseau , donc pour les éléments qui forment régulièrement des liaisons avec des ions 2+, leur énergie de réseau sera toujours plus grande que celle d’un atome plus petit avec une charge plus faible.
Qu’est-ce que l’effet d’énergie de treillis ?
L’énergie de treillis est un type d’ énergie potentielle qui peut être définie de deux façons. Dans une définition, l’ énergie de treillis est la énergie nécessaire pour briser un solide ionique et convertir les atomes qui le composent en ions gazeux. C’est ce qui fait que les solides ioniques ont des points de fusion et d’ébullition si élevés.
Pourquoi l’énergie du réseau est-elle importante ?
L’énergie de réseau nous donne des informations sur la stabilité des solides ioniques en nous indiquant la force des forces qui maintiennent leurs ions ensemble. Elle peut se référer soit à la quantité de énergie nécessaire pour briser un solide ionique en ses ions gazeux, soit à la quantité de énergie libérée lorsque les ions gazeux s’unissent pour former un solide ionique.
Lequel a le plus d’énergie de réseau NaCl ou MgCl2 ?
U( MgCl2 ) = 2477 ; U( NaCl ) = 769 kJ mol^-1 Une énergie de maille plus élevée implique une meilleure stabilité signifiant des liaisons plus fortes.
Pourquoi l’énergie d’ionisation diminue-t-elle de haut en bas ?
L’ énergie d’ionisation des éléments d’une même période augmente généralement de gauche à droite. Cela est dû à la stabilité de la coquille de valence. L’énergie d’ionisation des éléments au sein d’un groupe diminue généralement de haut en bas . Ceci est dû au blindage électronique.
Qu’est-ce que ie1 ?
Réponses : (1) L’énergie d’ionisation ou l’enthalpie d’ionisation est l’énergie requise pour enlever l’électron le plus faiblement lié d’un atome gazeux isolé . et IE1 , IE2 , il s’agit de l’enlèvement du premier ainsi que du deuxième électron d’un atome .
.
Pourquoi l’énergie d’ionisation augmente-t-elle drastiquement ?
Les énergies d’ionisation successives augmentent en magnitude parce que le nombre d’électrons, qui provoquent la répulsion, diminue régulièrement. Ainsi, la quantité d’ énergie nécessaire pour enlever des électrons au-delà des électrons de valence est considérablement plus grande que l’ énergie des réactions chimiques et de la liaison.
Quel atome a une énergie potentielle plus élevée l’argon ou le chlore ?
L’atome d’argon est plus grand que l’atome de chlore parce que, L’atome de chlore a 3 coquilles les plus externes qui tournent autour de lui et il a sept électrons de valence et sa valence est 1. Mais L’argon a 4 coquilles les plus externes et a la structure Octet. Il est donc stable.
Pourquoi l’énergie d’ionisation augmente-t-elle à travers une période ?
L’ énergie d’ionisation d’un élément augmente à mesure que l’on se déplace à travers une période du tableau périodique parce que les électrons sont maintenus plus serrés par la charge nucléaire effective plus élevée.
Comment la loi de Coulomb se rapporte-t-elle au rayon atomique ?
Radios atomiques en fonction du Nombre atomique une corrélation inverse. Selon la Loi de Coulomb , lorsque le nombre atomique augmente dans une série d’ atomes , l’attraction nucléaire pour les électrons augmentera également, rapprochant ainsi le ou les électrons du noyau.
Pourquoi l’affinité électronique diminue-t-elle vers le bas d’un groupe ?
Moins un atome a de valence électrons , moins il a de chances de gagner des électrons . L’affinité électronique diminue vers le bas des groupes et de droite à gauche à travers les périodes du tableau périodique car les électrons sont placés dans un niveau d’énergie plus élevé loin du noyau, d’où une diminution de son attraction.
Qu’est-ce que l’enthalpie d’ionisation en chimie ?
L’enthalpie d’ionisation des éléments est la quantité d’énergie dont un atome gazeux isolé a besoin pour perdre un électron dans son état fondamental. Il faut fournir une quantité spécifique d’énergie pour enlever un électron d’un atome. Par conséquent, les enthalpies d’ionisation des éléments chimiques sont toujours positives.
Que représentent q1 et q2 dans la loi de Coulomb ?
où Q1 représente la quantité de charge sur l’objet 1 (en Coulombs ), Q2 représente la quantité de charge sur l’objet 2 (en Coulombs ), et d représente la distance de séparation entre les deux objets (en mètres). Le symbole k est une constante de proportionnalité connue sous le nom de Coulomb’s law constant.
Pourquoi la loi de Coulomb est-elle importante ?
Elle signifie, la dépendance au carré inverse de la force électrique. Elle peut également être utilisée pour fournir des dérivations relativement simples de la loi de Gauss pour des cas généraux avec précision. Enfin, la forme vectorielle de la loi de Coulomb est importante car elle nous aide à préciser la direction des champs électriques dus aux charges.
Pourquoi la force d’attraction est-elle négative ?
Bien sûr, la force gravitationnelle est toujours attractive , donc ce signe moins est toujours présent, mais dans différents types de forces comme la force de Coulomb, un module négatif signifie une force attractive tandis qu’un module positif signifie une force répulsive, et le signe du module provient du signe des charges.
Pourquoi l'énergie d'ionisation augmente-t-elle drastiquement ?","acceptedAnswer": {"@type": "Answer","text": "Les énergies d'ionisation successives augmentent en magnitude parce que le nombre d'électrons, qui provoquent la répulsion, diminue régulièrement. Ainsi, la quantité d'énergie nécessaire pour enlever des électrons au-delà des électrons de valence est considérablement plus grande que l'énergie des réactions chimiques et de la liaison." } }, {"@type": "Question","name": "Quel atome a une énergie potentielle plus élevée l'argon ou le chlore ?","acceptedAnswer": {"@type": "Answer","text": "L'atome d'argon est plus grand que l'atome de chlore parce que,L'atome de chlore a 3 coquilles les plus externes qui tournent autour de lui et il a sept électrons de valence et sa valence est 1. Mais L'argon a 4 coquilles les plus externes et a la structure Octet. Il est donc stable." } }, {"@type": "Question","name": "Pourquoi l'énergie d'ionisation augmente-t-elle à travers une période ?","acceptedAnswer": {"@type": "Answer","text": "L'énergie d'ionisation d'un élément augmente à mesure que l'on se déplace à travers une période du tableau périodique parce que les électrons sont maintenus plus serrés par la charge nucléaire effective plus élevée." } }, {"@type": "Question","name": "Comment la loi de Coulomb se rapporte-t-elle au rayon atomique ?","acceptedAnswer": {"@type": "Answer","text": "Radios atomiques en fonction du Nombre atomique une corrélation inverse. Selon la Loi de Coulomb, lorsque le nombre atomique augmente dans une série d'atomes, l'attraction nucléaire pour les électrons augmentera également, rapprochant ainsi le ou les électrons du noyau." } }, {"@type": "Question","name": "Pourquoi l'affinité électronique diminue-t-elle vers le bas d'un groupe ?","acceptedAnswer": {"@type": "Answer","text": "Moins un atome a de valence électrons, moins il a de chances de gagner des électrons. L'affinité électronique diminue vers le bas des groupes et de droite à gauche à travers les périodes du tableau périodique car les électrons sont placés dans un niveau d'énergie plus élevé loin du noyau, d'où une diminution de son attraction." } }, {"@type": "Question","name": "Qu'est-ce que l'enthalpie d'ionisation en chimie ?","acceptedAnswer": {"@type": "Answer","text": "L'enthalpie d'ionisation des éléments est la quantité d'énergie dont un atome gazeux isolé a besoin pour perdre un électron dans son état fondamental. Il faut fournir une quantité spécifique d'énergie pour enlever un électron d'un atome. Par conséquent, les enthalpies d'ionisation des éléments chimiques sont toujours positives." } }, {"@type": "Question","name": "Que représentent q1 et q2 dans la loi de Coulomb ?","acceptedAnswer": {"@type": "Answer","text": "où Q1 représente la quantité de charge sur l'objet 1 (en Coulombs), Q2 représente la quantité de charge sur l'objet 2 (en Coulombs), et d représente la distance de séparation entre les deux objets (en mètres). Le symbole k est une constante de proportionnalité connue sous le nom de Coulomb's law constant." } }, {"@type": "Question","name": "Pourquoi la loi de Coulomb est-elle importante ?","acceptedAnswer": {"@type": "Answer","text": "Elle signifie, la dépendance au carré inverse de la force électrique. Elle peut également être utilisée pour fournir des dérivations relativement simples de la loi de Gauss pour des cas généraux avec précision. Enfin, la forme vectorielle de la loi de Coulomb est importante car elle nous aide à préciser la direction des champs électriques dus aux charges." } }] }