L’hydrure de lithium et d’aluminium peut-il réduire les alcènes ?
L’hydrure de lithium et d’aluminium (LiAlH4) est un agent réducteur puissant qui peut être utilisé pour réduire les alcènes. Par exemple, LiAlH4 peut être utilisé pour réduire la double liaison d’un alcène en une simple liaison, ce qui donne un alcane. LiAlH4 est également un réactif utile pour la synthèse d’alcools et d’amines.
L’hydrure de lithium et d’aluminium ne réduit pas les alcènes ou les arènes simples. Les alcynes ne sont réduits que si un groupe alcool est à proximité. On a observé que le LiAlH4 réduit la double liaison dans les N-allylamides.
Pourquoi le LiAlH4 peut-il réduire les alcènes ?
LiAlH4 est un réducteur nucléophile assez dur (principe HSAB) ce qui signifie qu’il réagit avec des électrophiles, et les alcènes ne sont pas des électrophiles. La raison principale est que Al doit éliminer son hydrure. Mais le carbone lié à l’alcool ne peut pas se charger d’un hydrure.
L’hydrure de lithium et d’aluminium réduit-il la double liaison ?
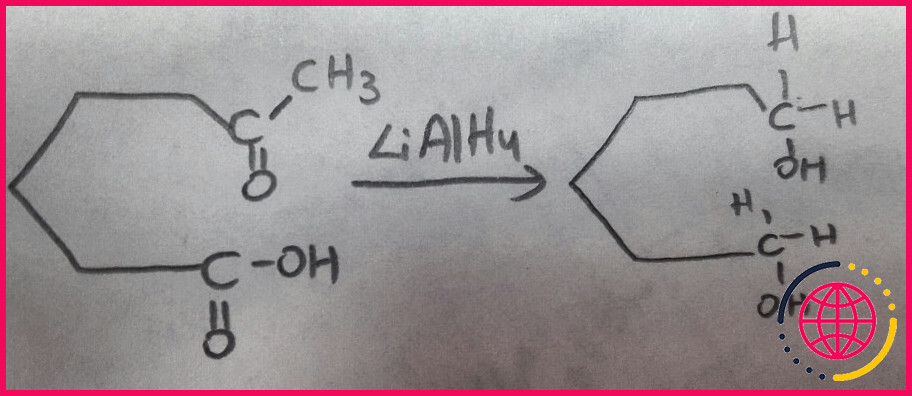
LiAlH4 est un agent réducteur fort et non sélectif des doubles liaisons polaires, le plus facilement considéré comme une source de H-. Il réduira les aldéhydes, cétones, esters, chlorures d’acides carboxyliques, acides carboxyliques et même les sels de carboxylate en alcools.
LiAlH4 réduit-il les alcènes ?
L’hydrure de lithium et d’aluminium ne réduit pas les alcènes ou arènes simples. Les alcynes ne sont réduits que si un groupe alcool est à proximité. On a observé que le LiAlH4 réduit la double liaison dans les N-allylamides.
Que se passe-t-il lorsque l’hydrure de lithium et d’aluminium réduit ?
L’hydrure de lithium et d’aluminium (LiAlH4) est un agent réducteur puissant. Il réduira presque tout groupe fonctionnel contenant C=O en un alcool. Un équivalent de H- s’ajoute, puis un autre équivalent s’ajoute, inévitablement.
Pourquoi le NaBH4 est-il meilleur que le LiAlH4 ?
La différence essentielle entre LiAlH4 et NaBH4 est que LiAlH4 peut réduire les esters, les amides et les acides carboxyliques alors que NaBH4 ne peut pas les réduire. Mais LiAlH4 est un agent réducteur très fort que NaBH4 car la liaison Al-H dans le LiAlH4 est plus faible que la liaison B-H dans NaBH4. Cela rend la liaison Al-H moins stable.
Comment manipule-t-on l’hydrure de lithium et d’aluminium ?
Il est généralement fourni sous la forme d’une fine poudre poussée. L’hydrure de lithium et d’aluminium réagit vigoureusement avec l’eau, les acides et les alcools et peut facilement s’enflammer. L’hydrure d’aluminium ne doit être ouvert qu’à l’intérieur d’une hotte de travail ou, de préférence, d’une boîte à gants.
Est-ce que LiAlH4 réduit les éthers ?
LiAlH4 (dans l’éther) réduit les aldéhydes, les acides carboxyliques et les esters en 1° alcools et les cétones en 2° alcools. Acides et esters – LiAlH4 (mais pas NaBH4 ou hydrogénation catalytique). 15.4 : Préparation d’alcools à partir d’époxydes – le cycle à trois chaînons d’un époxyde est mis sous tension.
Le NaBH4 peut-il réduire les alcynes ?
Cette combinaison de réactifs, connue sous le nom de catalyseur de Lindlar, réduira également l’alcène seul. Ce réactif est typiquement utilisé pour réduire sélectivement un alcyne en alcène.
Pourquoi le NaBH4 ne réduit pas l’acide carboxylique ?
Le carbone carbonyle d’un acide carboxylique est encore plus électrophile que le carbone carbonyle d’un aldéhyde ou d’une cétone. Pour cette raison, le borohydrure de sodium ne réduit pas un acide carboxylique. Un acide carboxylique peut réagir avec un alcool, en présence d’une petite quantité d’un acide, pour former un ester d’acide carboxylique.
Comment éteindre l’hydrure de lithium et d’aluminium ?
Il existe plusieurs façons de tremper l’hydrure de lithium aluminium.
- L’addition goutte à goutte d’un sulfate de sodium aqueux saturé (Na2SO4).
- Pour chaque (un) gramme d’hydrure de lithium alumninium utilisé, ajouter goutte à goutte un ml d’eau suivi d’un ml de NaOH aqueux à 15% et, enfin, 3 ml d’eau.
Pourquoi l’hydrure de lithium aluminium est-il plus réactif ?
Parce que l’aluminium est moins électronégatif que le bore, la liaison Al-H dans LiAlH4est plus polaire, ce qui rend LiAlH4 un agent réducteur plus fort.
Quel métal est utilisé pour la réduction des doubles liaisons ?
le platine est utilisé comme PtO2, le catalyseur d’Adams, bien que ce soit en réalité le métal de platine qui soit le catalyseur. L’hydrogène utilisé pour ajouter à la double liaison carbone-carbone réduit également l’oxyde de platine(IV) en métal de platine finement divisé. L’éthanol ou l’acide acétique est utilisé comme solvant de l’alcène.
LiAlH4 peut-il réduire le nitrobenzène ?
Indice :L’hydrure de lithium et d’aluminium est un agent réducteur puissant des doubles liaisons polaires. Comme le groupe nitro contient des doubles liaisons polaires, l’hydrure de lithium et d’aluminium réduit les composés nitro aromatiques en produits azoïques.
Est-ce que NaBH4 réduit les doubles liaisons ?
LiAlH4 réduit la double liaison seulement quand la double liaison est Beta-arly , NaBH4 ne réduit pas la double liaison. si vous voulez vous pouvez utiliser H2/Ni pour réduire une double liaison.
LiAlH4 est-il une base ?
L’ion hydrure du LiAlH4 est très basique. Pour cette raison, LiAlH4 réagit violemment avec l’eau et doit donc être utilisé dans des solvants secs comme l’éther anhydre et le THF. Comme beaucoup d’autres bases fortes, l’ion hydrure dans LiAlH4 est un bon nucléophile, et LiAlH4 contient son propre acide de Lewis « intégré », l’ion lithium.
Est-ce que NaBH4 réduit les éthers ?
Le borohydrure de sodium est relativement insoluble dans les solvants d’éther, donc ceux-ci sont rarement utilisés pour les réductions de borohydrure. Les solutions éthanoliques de borohydrure de sodium réduisent les aldéhydes et les cétones en présence d’époxydes, d’esters, de lactones, d’acides, de nitriles ou de groupes nitro. 27,33. La réduction des aldéhydes est simple.
Le NaBH4 peut-il réduire les imines ?
Borohydrure de sodium : NaBH4 également efficace pour réduire les imines.
Quel réactif peut être utilisé pour réduire une cétone ?
Les aldéhydes et les cétones sont réduits par la plupart des agents réducteurs. Le borohydrure de sodium et l’hydrure d’aluminium de lithium sont des agents réducteurs très courants.
Quel est le meilleur solvant à utiliser avec le LiAlH4 ?
Le meilleur solvant pour LiAlH4 est l’éther diéthylique (6 mol/l). Dans le THF, seulement 3 mol/l sont solubles. Par conséquent, l’éther diéthylique pourrait être un meilleur solvant.
Que fait LiAlH4 aux esters ?
Ch20 : Réduction des esters en utilisant LiAlH4 pour donner 1o alcools. Les esters carboxyliques sont réduits donnent 2 alcools, un de la partie alcool de l’ester et un 1.o alcool provenant de la réduction de la partie carboxylate. Les esters sont moins réactifs vis-à-vis de Nu que les aldéhydes ou les cétones.
Lorsque l’hydrure de lithium aluminium réagit avec la pyridine, quel produit n’est pas formé ?
Lorsque l’hydrure de lithium et d’aluminium réagit avec la pyridine, quel produit n’est pas formé ? Explication : Les dérivés partiellement hydrogénés sont obtenus dans des conditions plus douces, la réduction avec l’hydrure de lithium et d’aluminium donne un mélange de 1,4-dihydropyridine, 1,2-dihydropyridine et 2,5-dihydropyridine.
De quels EPI auriez-vous besoin pour manipuler en toute sécurité l’hydrure de lithium et d’aluminium ?
Lorsque l’on travaille avec du LAH ou d’autres matériaux pyrophoriques, il faut au minimum une blouse de laboratoire ignifugée, ainsi que des lunettes de protection, et des gants.
Qu’est-ce qui réagit avec l’hydrure de lithium ?
L’hydrure de lithium et d’aluminium réagit violemment avec l’eau pour former de l’hydrogène gazeux, qui peut brûler de manière explosive en raison de la chaleur générée par la réaction. Par conséquent, l’hydrure de lithium et d’aluminium ne peut être utilisé que dans des solvants aprotiques comme l’éther diéthylique. L’anion borohydrure est beaucoup moins réactif que l’hydrure d’aluminium.
L’hydrure de lithium est-il toxique ?
Sécurité. Le LiH réagit violemment avec l’eau pour donner de l’hydrogène gazeux et du LiOH, qui est caustique. Certains sels de lithium, qui peuvent être produits dans les réactions du LiH, sont toxiques.