Pourquoi le carbone présente-t-il des formes allotropiques ?
Le carbone (C) est l’élément le plus abondant sur Terre, représentant environ 24 % de la croûte terrestre. Mais malgré sa prévalence, les scientifiques ont été incapables de créer un seul allotrope de carbone à partir d’atomes de carbone purs – jusqu’à récemment.
Les allotropes sont des formes d’un élément qui diffèrent par leurs propriétés physiques et chimiques de la forme standard. Jusqu’à présent, on croyait que les allotropes étaient impossibles pour les atomes de carbone purs car ils n’obéissent pas aux lois de la thermodynamique, qui régissent la distribution et l’utilisation de l’énergie dans la matière.
Mais des expériences récentes menées par une équipe de scientifiques chinois ont montré que des allotropes peuvent se former lorsque les atomes de carbone sont soumis à des températures et des pressions extrêmes. En modifiant la température et la pression en dessous desquelles ces formes se produisent, les scientifiques ont également pu contrôler quelle forme allotropique se formait.
Les résultats pourraient avoir un impact significatif sur la façon dont nous utilisons et stockons le dioxyde de carbone, ainsi que sur le développement de nouvelles technologies qui utilisent le carbone.
Le carbone montre de l’allotropie car il existe sous différentes formes de carbone. Bien que ces allotropes de carbone aient une structure cristalline différente et des propriétés physiques différentes, leurs propriétés chimiques sont les mêmes et montrent des propriétés chimiques similaires. Le diamant et le graphite ont tous deux le symbole C.
Pourquoi les allotropes se forment-ils ?
Les allotropes énantiotropes ont plusieurs formes, chacune d’entre elles étant stable dans différents ensembles de conditions. Il est possible de convertir une forme en une autre forme en changeant ces conditions (comme la température et la pression). Les éléments carbone, oxygène, soufre, étain et phosphore ont tous des formes allotropiques.
Quelles sont les formes allotropiques du carbone ?
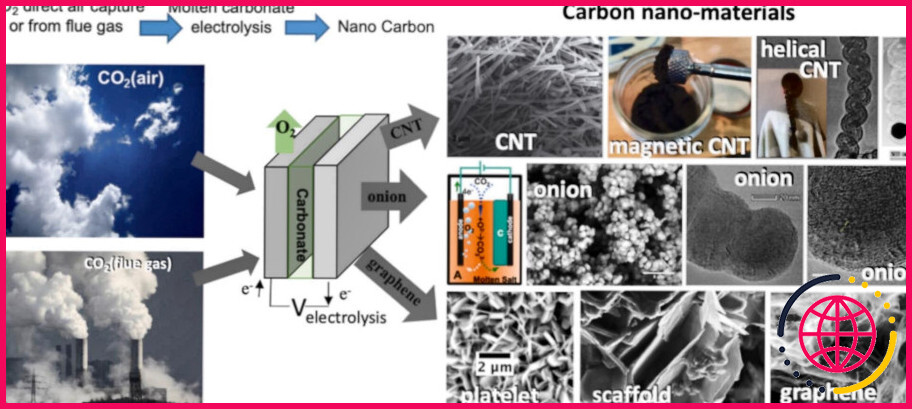
Le diamant, le graphite et les fullerènes (substances comprenant des nanotubes et des » buckyballs » , comme le buckminsterfullerène) sont trois allotropes du carbone pur.
Comment se forment les allotropes du carbone ?
Lorsqu’un élément existe sous plus d’une forme cristalline, ces formes sont appelées allotropes ; les deux allotropes de carbone les plus courants sont le diamant et le graphite. Chaque atome de carbone est lié de manière covalente aux quatre coins du tétraèdre à quatre autres atomes de carbone.
Combien de formes allotropiques du carbone existe-t-il ?
Utilisez la fiche d’information ci-jointe et l’activité de carte flash différenciée pour explorer les différentes propriétés et utilisations de quatre allotropes du carbone – le diamant, le graphite, le graphène et le buckminsterfullerène.
Quelle est la forme la plus pure du carbone ?
Le diamant est la forme la plus pure du carbone. Les différentes formes d’une même substance chimique sont appelées allotropes. Le graphite et le diamant sont deux allotropes majeurs du carbone.
Le coca est-il un allotrope du carbone ?
Le diamant, le graphite, le graphène et le fullerène sont des allotropes cristallins du carbone. Le coke et le charbon sont des allotropes amorphes du carbone.
Quels sont les 3 types de carbone ?
Les trois allotropes de carbone relativement connus sont le carbone amorphe, le graphite et le diamant. Autrefois considérés comme exotiques, les fullerènes sont aujourd’hui couramment synthétisés et utilisés en recherche ; ils comprennent les buckyballs, les nanotubes de carbone, les nanobuds et les nanofibres de carbone.
Quel est l’allotrope le plus doux du carbone ?
Le diamant est le minéral le plus dur connu (10 sur l’échelle de Mohs), mais le graphite est l’un des plus mous (1-2 sur l’échelle de Mohs).
Quels sont les deux types d’allotropie ?
Les allotropes du carbone peuvent être classés en deux catégories :
- Les allotropes de carbone amorphe.
- Allotropes de carbone cristallin.
Quelles sont les 4 formes du carbone ?
Il existe plusieurs allotropes de carbone. Allotropes de carboneAllotropes de carbone : a) le diamant, b) le graphite, c) la lonsdaleite, d) le C60 (Buckminsterfullerène ou buckyball), e) le C540, f) le C70, g) le carbone amorphe, et h) le nanotube de carbone à paroi unique, ou buckytube.
Qu’est-ce que l’exemple de l’allotropie ?
Le terme allotrope désigne une ou plusieurs formes d’un élément chimique qui se présentent dans le même état physique. Par exemple, le graphite et le diamant sont tous deux des allotropes du carbone qui se produisent à l’état solide. Le graphite est mou, tandis que le diamant est extrêmement dur.
Qu’est-ce que la caténation donner un exemple ?
Définition de la caténation : La caténation est la liaison d’un élément à lui-même par des liaisons covalentes pour former des molécules en chaîne ou en anneau. Exemples : Le carbone est l’élément le plus courant qui présente une caténation. Il peut former de longues chaînes d’hydrocarbures et des cycles comme le benzène.
Que sont les allotropes classe 10 ?
Les allotropes sont deux ou plusieurs formes d’un même élément existant dans le même état physique (soit solide, soit liquide, soit gazeux) qui diffèrent les unes des autres par leurs propriétés physiques, et parfois aussi chimiques.
Quelle est la différence entre les allotropes et les isomères ?
Les allotropes peuvent être définis comme différents types de composés constitués d’un même élément unique mais dans des formules chimiques et des arrangements différents. Les isomères peuvent être définis comme les composés chimiques qui ont une formule moléculaire similaire mais avec des formules structurelles différentes.
Les allotropes sont-ils des molécules ?
Certains allotropes d’éléments ont des formules moléculaires différentes. Par exemple, le dioxygène (O2) et l’ozone (O3) existent sous forme d’allotropes séparés en phase solide, liquide et gazeuse. Certains éléments ont plusieurs allotropes en phase solide, mais une seule forme liquide et gazeuse. D’autres ont des allotropes liquides et gazeux.
Quel est le carbone le plus mou ?
La forme la plus tendre du carbone est le graphite. Le graphite est si mou qu’il peut former une strie sur le papier.
Pourquoi le charbon n’est pas un allotrope du carbone ?
La forme amorphe est constituée par le charbon et le fusain. Le fullerène est constitué d’une forme buckyballs. Comme le dioxyde de carbone n’est pas à l’état élémentaire du carbone, il ne peut pas former l’allotrope du carbone.
Quelle forme allotrope du carbone a la plus faible énergie ?
Conclusions . En résumé, nous avons effectué une analyse théorique des stabilités relatives des allotropes de carbone de plus basse énergie existant dans la nature : graphite (graphène), diamant et lonsdaleite.
Les diamants sont-ils 100% carbone ?
Le diamant est la seule gemme composée d’un seul élément : Il est généralement composé d’environ 99,95 % de carbone. Le diamant se forme dans des conditions de température et de pression élevées qui n’existent que dans une plage de profondeur spécifique (environ 100 miles) sous la surface de la terre.
A quoi ressemble le carbone pur ?
Le carbone pur peut être trouvé sous trois formes différentes : le diamant, le graphite et le noir de carbone. Le diamant et le graphite sont tous deux cristallins mais diffèrent par la façon dont leurs atomes sont disposés. Le diamant est la substance naturelle la plus dure connue, tandis que le graphite est doux et glissant.
Lequel n’est pas une forme de carbone ?
Ce n’est pas un allotrope du carbone. Ainsi, nous avons vu que le microtubule est la seule option qui n’est pas un allotrope du carbone. Par conséquent, la réponse à la question donnée est l’option (C).
Quel type de carbone est le coke ?
Le coke est un produit à haute teneur en carbone couramment produit dans les sous-produits des fours à coke par la distillation destructive du charbon.
L’eau est-elle un allotrope ?
Puisque l’eau est un composé contenant deux atomes d’hydrogène, et un atome d’oxygène, donc c’est un composé chimique. Les allotropes ne peuvent exister sous aucune forme composée, plutôt ils sont des formes élémentaires. Donc, l’eau ne peut pas être qualifiée d’allotrope.
Le coke est-il la même chose que le carbone ?
Le coke est un combustible qui est obtenu par la calcination ou la distillation sèche du charbon minéral. Il est composé de carbone et possède un fort pouvoir calorifique, mais il est très polluant. Il est utilisé comme combustible dans les hauts fourneaux des fonderies d’acier.