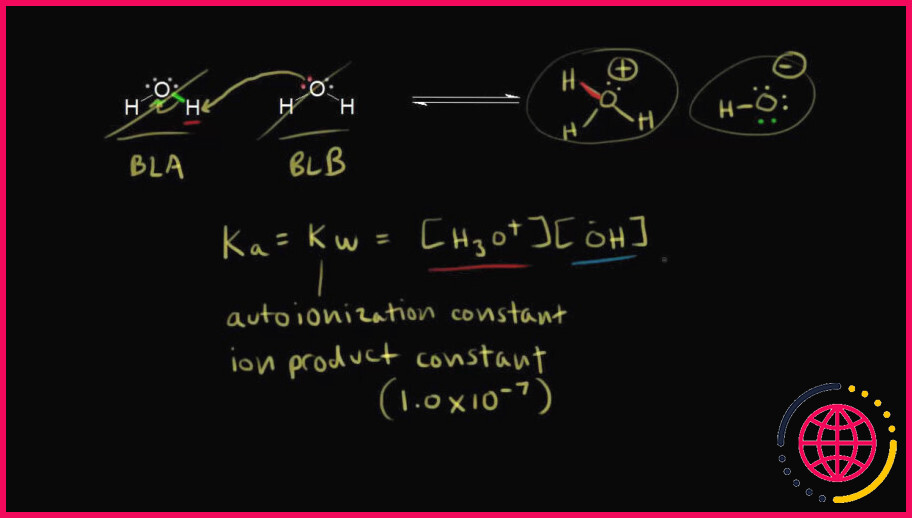
Pourquoi les concentrations de h3o+ et de oh sont-elles égales dans l’eau pure ?
Question : Pourquoi les concentrations de [H3O +]et [ OH −] sont-elles égales dans l’eau pure ? A) H3O+ ]=[ OH −] Parce que toute solution doit contenir une concentration égale de particules acides et basiques. B) H3O+ ]=[ OH −] Parce que [ H3O +]et [ OH −] forment une paire acide-base conjuguée.
La question est aussi : quelles sont les concentrations de h3o+ et de OH dans l’eau pure ?
Dans l’ eau pure , à 25C, les concentrations des ions [H3O+] et [ OH –] sont de 1,0 x 10–7 M. La valeur de Kw à 25C est donc de 1,0 x 10–14. Bien que Kw soit défini en termes de dissociation de l’ eau , cette expression de la constante d’équilibre est également valable pour les solutions d’acides et de bases dissoutes dans l’ eau .
De même, qu’arrive-t-il à la concentration des ions h3o+ et OH lorsque de l’eau est ajoutée à une base ?
L’eau est techniquement à la fois un acide et une base . Un déplacement du nombre d’ ions H+ où ils sont plus nombreux que les OH – ions entraînerait une baisse du pH et la solution serait acide. Un déplacement du nombre d’ions H+ où ils étaient moins nombreux que les OH – ions entraînerait une augmentation du pH.
Alors, pourquoi les concentrations de h3o +] et de oh – sont-elles égales dans l’eau pure ?
A)[ H3O+ ]=[ OH− ] parce qu’un de chaque est produit chaque fois qu’un [H +] transfert d’une eau molécule à une autre. B)[ H3O+ ]=[ OH− ] parce que toute solution doit contenir une concentration égale de particules acides et basiques.
Quelle est la formule pour calculer le pH ?
Vous pouvez calculer le pH d’une solution acide ou basique étant donné la concentration de l’ion hydronium en utilisant la formule pH = -log [ H3O+] ou si l’on donne la concentration de l’ion hydroxyde par la formule [ H3O+] = Kw / [OH-], puis en utilisant la formule pH = -log [ H3O+] .
Que représente H+ dans l’eau pure ?
Dans l’eau pure , la concentration en ions hydrogène, [H+], est égale à la concentration en ions hydroxyde, [OH–]. Le pH de l’ eau pure est de 7, soit le logarithme négatif de 1 X 10–7. Une solution neutre est une solution qui n’est ni acide ni basique. La concentration en ions hydrogène est égale à la concentration en ions hydroxyde, et les deux sont égales à 1 X 10–7 M.
Quel est le pKa de l’eau pure à 25 C ?
Le pKa de l’ eau à 25 ° C est de 14,0 et non de 15,7(4) comme couramment cité.
Quel est le pH de l’eau pure ?
7
Quelle est la valeur de KW à 25 _firxam_#8728 ; C ?
La valeur de Kw à 25 degrés Celsius est précisément 1×10-14 1 × 10 – 14 . Kw est un exemple de constante d’équilibre.
Que présente l’eau pure ?
L’eau , H2O, est une substance pure , un composé constitué d’hydrogène et d’oxygène. Bien que l’ eau soit la substance la plus abondante sur terre, on la trouve rarement à l’état naturel sous sa forme pure . La plupart du temps, l’ eau pure doit être créée. L’eau pure est appelée eau distillée ou eau déionisée .
Qu’est-ce qui rend l’eau pure neutre ?
Le pH étant défini comme le log négatif de la concentration en ions hydrogène, le pH de l’ eau pure est de 7 ou neutre . L’eau pure est neutre car le nombre d’ions hydrogène positifs produits est égal au nombre d’ions négatifs.
Que se passe-t-il quand on dilue une base ?
Dilution des acides et des bases
L’eau est principalement constituée de molécules d’eau, donc ajouter de l’eau à un acide ou à une base réduit la concentration des ions dans la solution. Lorsqu’une solution acide est diluée avec de l’eau, la concentration en ions H + diminue et le pH de la solution augmente vers 7.
Comment le kW affecte-t-il le pH ?
Pour trouver le pH , vous devez d’abord trouver la concentration en ions hydrogène (ou en ions hydroxonium – c’est la même chose). Ensuite, vous la convertissez en pH . Mais dans l’eau pure, la concentration en ions hydrogène (ions hydroxonium) doit être égale à la concentration en ions hydroxyde.
| T (°C) | Kw (mol2 dm–6) | pH |
|---|---|---|
| 100 | 51,3 x 10–14 | 6,14 |
Le pH peut-il être négatif ?
Il est tout à fait possible de calculer une valeur négative du pH . En pratique, tout acide qui donne une concentration d’ions hydrogène avec une molarité supérieure à 1 sera calculé pour avoir un pH négatif. Par exemple, le pH de 12M HCl (acide chlorhydrique) est calculé pour être -log(12) = -1,08.
Quelle est l’équation de l’auto-ionisation de l’eau ?
L’eau peut subir une autoionisation pour former H 3 O + extH_3 extO^+ H3O+texte de départ, H, texte de fin, indice de départ, 3, indice de fin, texte de départ, O, texte de fin, indice de départ, plus, indice de fin et ions OH-texte de départ, O, H, texte de fin, indice de départ, moins, indice de fin.
Qu’est-ce que le pKw ?
pH, pOH, et pKw Étant donné le pH et le pOH, comment pensez-vous que pKw est calculé ? pKw = ? log Kw Le pKw de l’eau pure à 25?C est ? ??? ? ? = – ?????? ? ? × ????- ???? = ????
Qu’est-ce qui fait un acide fort ?
Un acide fort est tout acide qui s’ionise complètement en solution. Cela signifie qu’il dégage le plus grand nombre d’ions hydrogène ou de protons lorsqu’il est placé dans une solution. Les ions sont des particules chargées. Cela signifie qu’il possède un proton, et donc qu’un ion hydrogène est essentiellement un proton.
Que signifie pH ?
hydrogène potentiel
Le NaOH est-il un acide ou une base ?
NaOH est une base car lorsqu’il est dissous dans l’eau, il se dissocie en ions Na+ et OH-. C’est le OH- (ion hydroxyle) qui fait du NaOH une base . En termes classiques, une base est définie comme un composé qui réagit avec un acide pour former du sel et de l’eau, comme représenté par l’équation suivante.
Le pH affecte-t-il l’équilibre ?
Ajouter plus d’ions OH- augmente le pH et rend la substance plus basique. Pour les réactions qui ont des ions OH- du côté du produit : l’augmentation du pH augmentera le nombre d’ions OH-, donc l’ équilibre se déplacera vers la gauche. Diminuer le pH augmentera le nombre d’ions H3 O+.
Comment trouver la concentration de OH ?
Trouvez le [ OH –] étant donné le pH ou le pOH. On vous donne que le pH = 4,5. Trouvez la concentration en ions hydroxyde d’une solution dont le pOH est de 5,90. Pour résoudre cette question, utilisez une calculatrice scientifique et entrez 5,90 et utilisez le bouton +/- pour le rendre négatif, puis appuyez sur la touche 10x.
Que se passe-t-il lorsqu’on ajoute une base forte à l’eau ?
Si l’on ajoute un acide fort ou une base forte à de l’ eau , le pH va changer radicalement. Lorsque ce solide est ajouté à l’eau , les ions flottent à part, conduisant à des ions OH– supplémentaires dans l’ eau : NaOH → OH– + Na+. La grande concentration de OH– qui en résulte rend la solution plus basique et conduit à une augmentation spectaculaire du pH.
L'eau est principalement constituée de molécules d'eau, donc ajouter de l'eau à un acide ou à une base réduit la concentration des ions dans la solution. Lorsqu'une solution acide est diluée avec de l'eau, la concentration en ions H + diminue et le pH de la solution augmente vers 7." } }, {"@type": "Question","name": " Le pH peut-il être négatif ? ","acceptedAnswer": {"@type": "Answer","text": " Il est tout à fait possible de calculer une valeur négative du pH. En pratique, tout acide qui donne une concentration d'ions hydrogène avec une molarité supérieure à 1 sera calculé pour avoir un pH négatif. Par exemple, le pH de 12M HCl (acide chlorhydrique) est calculé pour être -log(12) = -1,08." } }, {"@type": "Question","name": " Quelle est l'équation de l'auto-ionisation de l'eau ? ","acceptedAnswer": {"@type": "Answer","text": " L'eau peut subir une autoionisation pour former H 3 O + extH_3 extO^+ H3O+texte de départ, H, texte de fin, indice de départ, 3, indice de fin, texte de départ, O, texte de fin, indice de départ, plus, indice de fin et ions OH-texte de départ, O, H, texte de fin, indice de départ, moins, indice de fin." } }, {"@type": "Question","name": " Qu'est-ce que le pKw ? ","acceptedAnswer": {"@type": "Answer","text": " pH, pOH, et pKw Étant donné le pH et le pOH, comment pensez-vous que pKw est calculé ? pKw = ? log Kw Le pKw de l'eau pure à 25?C est ? ??? ? ? = - ?????? ? ? × ????- ???? = ????" } }, {"@type": "Question","name": " Qu'est-ce qui fait un acide fort ? ","acceptedAnswer": {"@type": "Answer","text": " Un acide fort est tout acide qui s'ionise complètement en solution. Cela signifie qu'il dégage le plus grand nombre d'ions hydrogène ou de protons lorsqu'il est placé dans une solution. Les ions sont des particules chargées. Cela signifie qu'il possède un proton, et donc qu'un ion hydrogène est essentiellement un proton." } }, {"@type": "Question","name": "Le NaOH est-il un acide ou une base ? ","acceptedAnswer": {"@type": "Answer","text": " NaOH est une base car lorsqu'il est dissous dans l'eau, il se dissocie en ions Na+ et OH-. C'est le OH- (ion hydroxyle) qui fait du NaOH une base. En termes classiques, une base est définie comme un composé qui réagit avec un acide pour former du sel et de l'eau, comme représenté par l'équation suivante." } }, {"@type": "Question","name": " Le pH affecte-t-il l'équilibre ? ","acceptedAnswer": {"@type": "Answer","text": " Ajouter plus d'ions OH- augmente le pH et rend la substance plus basique. Pour les réactions qui ont des ions OH- du côté du produit : l'augmentation du pH augmentera le nombre d'ions OH-, donc l'équilibre se déplacera vers la gauche. Diminuer le pH augmentera le nombre d'ions H3 O+." } }, {"@type": "Question","name": " Comment trouver la concentration de OH ? ","acceptedAnswer": {"@type": "Answer","text": " Trouvez le [OH-] étant donné le pH ou le pOH. On vous donne que le pH = 4,5. Trouvez la concentration en ions hydroxyde d'une solution dont le pOH est de 5,90. Pour résoudre cette question, utilisez une calculatrice scientifique et entrez 5,90 et utilisez le bouton +/- pour le rendre négatif, puis appuyez sur la touche 10x." } }] }