Quand est-ce que quelque chose est thermodynamiquement favorisé ?
La thermodynamique est la branche de la physique qui étudie les relations entre l’énergie et la matière. En particulier, la thermodynamique est chargée de déterminer quand quelque chose est énergétiquement favorisé. Cela signifie qu’en général, un processus sera plus favorable s’il utilise moins d’énergie. Les processus favorisés par la thermodynamique sont généralement plus rapides, plus faciles ou moins coûteux à mettre en œuvre que les processus qui nécessitent plus d’énergie.
L’entropie est l’un des concepts les plus importants de la thermodynamique. L’entropie est une mesure du désordre ou du chaos dans un système. Plus l’entropie d’un système est grande, plus il sera difficile pour le système d’atteindre l’équilibre (un état où toutes les parties constituantes sont en équilibre).
Il est impossible d’éliminer complètement l’entropie d’un système, mais certains processus peuvent augmenter considérablement l’entropie. Par exemple, chauffer une substance augmentera son entropie. Cela a du sens – après tout, chauffer quelque chose augmente son niveau d’énergie. Et comme la chaleur est un moyen de transférer de l’énergie d’une molécule à une autre, l’augmentation de l’entropie est généralement une mauvaise nouvelle pour les systèmes.
D’autre part, certains processus peuvent réduire considérablement l’entropie. Par exemple, la décomposition de molécules complexes en leurs atomes composants peut les rendre plus ordonnées (moins chaotiques) et plus faciles à manipuler. Ce processus est appelé catabolisme et c’est une partie importante du cycle biologique de Krebs (une série de réactions biochimiques impliquées dans la production d’ATP) et de la respiration cellulaire (le processus par lequel les cellules convertissent les nutriments en énergie).
En général, la favorabilité thermodynamique fait référence au fait qu’un processus utilise ou non moins d’énergie qu’un autre processus – et non au fait que les deux processus soient bons ou mauvais en eux-mêmes. Par exemple, la combustion du charbon produit de grandes quantités de chaleur et de fumée – qui sont toutes deux mauvaises pour la santé – mais la combustion du charbon est thermodynamiquement favorisée car elle utilise moins d’énergie que l’utilisation de l’électricité pour générer de la chaleur (ce qui nécessiterait des panneaux solaires ou des générateurs thermiques).
Si le ΔH d’une réaction est négatif, et que ΔS est positif, la réaction est toujours thermodynamiquement favorisée. Si le ΔH d’une réaction est positif, et que ΔS est négatif, la réaction est toujours thermodynamiquement défavorisée.
Qu’est-ce qui est plus favorisé thermodynamiquement ?
Re : Qu’est-ce que cela signifie pour une réaction d’être « thermodynamiquement favorisée » ? Les réactions qui ne nécessitent pas d’énergie sont considérées comme plus favorables. Puisque les réactions exothermiques libèrent de l’énergie et que les réactions endothermiques nécessitent de l’énergie, les réactions exothermiques sont plus favorables.
Quelle température est thermodynamiquement favorisée ?
Mathématiquement, ΔG ne devient positif que lorsque T est supérieure à 313K. De ce fait, la réaction est thermodynamiquement favorable à toute température inférieure à 313K (puisque ΔG sera négatif), mais n’est pas thermodynamiquement favorable à toute température supérieure à 313K (puisque ΔG sera positif).
Qu’est-ce qui détermine la stabilité thermodynamique ?
La stabilité thermodynamique dépend du caractère spontané ou non de la réaction. Cela dépend de la variation de l’énergie libre (ΔG). Une réaction thermodynamiquement stable est une réaction qui, fondamentalement, ne réagit pas. Par conséquent, elle est indépendante du chemin entre les réactifs et les produits.
Dans laquelle des conditions suivantes la réaction est-elle thermodynamiquement favorisée ?
La réaction est thermodynamiquement favorable uniquement à des températures supérieures à 25°C. À 25°C, le ∆G° de la réaction est positif.
Comment savoir si une équation est thermodynamiquement favorisée ?
Si le ΔH d’une réaction est négatif, et que le ΔS est positif, la réaction est toujours thermodynamiquement favorisée. Si le ΔH d’une réaction est positif, et que ΔS est négatif, la réaction est toujours thermodynamiquement défavorisée.
Comment savoir si une réaction est spontanée ?
Si ΔH est négatif, et -TΔS positif, la réaction sera spontanée à basse température (diminuant l’amplitude du terme entropique). Si ΔH est positif, et -TΔS négatif, la réaction sera spontanée à haute température (augmentation de l’amplitude du terme entropie).
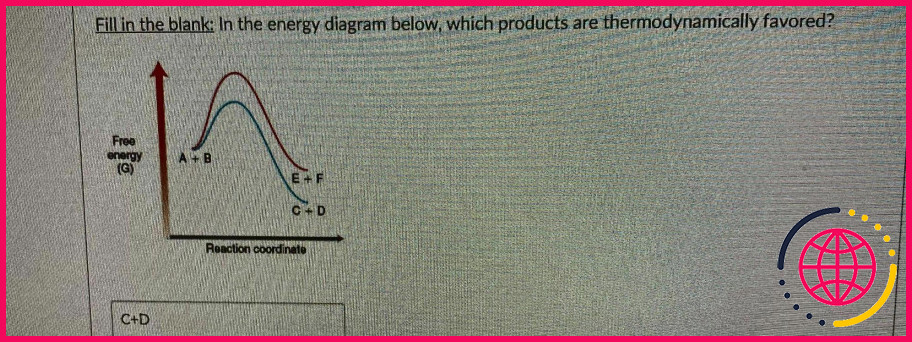
Quel produit est thermodynamiquement plus stable ?
Les produits thermodynamiques contiennent une double liaison interne et la réaction est réversible. De plus, lors des réactions, les produits thermodynamiques sont plus stables que les produits cinétiques car ils sont plus substitués.
Qu’est-ce qui est thermodynamiquement instable ?
Un système est dit thermodynamiquement instable lorsqu’il existe un état où le système aura une énergie inférieure à celle qu’il a actuellement. Une dispersion peut être thermodynamiquement instable, mais peut tout de même être cinétiquement stable.
Pourquoi une émulsion est thermodynamiquement instable ?
L’émulsion, d’un point de vue thermodynamique, est considérée comme instable parce qu’il existe une tendance naturelle pour un liquide ou un système liquide à se séparer et à réduire sa surface interfaciale et, par conséquent, son énergie interfaciale.
Que signifie » favorisé entropiquement » ?
(S) (en’trŏ-pē) Fraction du contenu en chaleur (énergie) qui n’est pas disponible pour l’exécution d’un travail, généralement parce que (dans une réaction chimique) elle a été utilisée pour augmenter le mouvement aléatoire des atomes ou des molécules dans le système ; donc, une mesure du caractère aléatoire ou du désordre.
Peut-on forcer une réaction favorisée par un réactif à se produire ?
Les processus favorisés par le réactif (∆G + ou E -) peuvent être forcés à se produire avec une source d’énergie externe comme une prise murale ou une batterie.
Une entropie plus élevée ou plus faible est-elle favorisée ?
Les réactions peuvent se produire lorsque l’enthalpie est transférée à l’environnement. Une réaction est favorisée si l’entropie augmente : Il y a également un biais dans la nature vers l’augmentation de l’entropie dans un système. Des réactions peuvent se produire lorsque l’entropie augmente.
Qu’est-ce qu’une réaction thermodynamiquement favorisée ?
Les processus ou réactions thermodynamiquement favorisés sont ceux qui impliquent à la fois une diminution de l’énergie interne des composants (ΔH°.<0) et une augmentation de l’entropie des composants (ΔS°>0). Ces processus sont nécessairement » thermodynamiquement favorisés » (ΔG°<0) ou négatifs.
Pourquoi est-il thermodynamiquement favorable ?
« Thermodynamiquement favorable » signifie de haute énergie à basse énergie, ou, dit autrement, de moins stable à plus stable. Comprendre la stabilité relative des molécules peut être important pour prédire la réactivité relative des matières premières et les rendements relatifs des produits potentiels.
Qu’est-ce qu’une réaction thermodynamiquement stable ?
Il y a stabilité thermodynamique lorsqu’un système est dans son état d’énergie le plus bas, ou en équilibre chimique avec son environnement. Il peut s’agir d’un équilibre dynamique dans lequel les atomes ou les molécules individuels changent de forme, mais leur nombre global sous une forme particulière est conservé.
Que signifie » thermodynamiquement possible » ?
Thermodynamiquement possible = selon tout ce que nous savons sur les changements d’énergie et d’entropie dans les réactions, il est raisonnable de supposer que cela peut se produire. TLDR. possible. De plus, le fait de libérer des électrons signifie-t-il que c’est un agent réducteur – oui. 0.
Qu’est-ce qu’un produit stable ?
Un exemple de stable est un produit dont le prix est stable et immuable.
Pourquoi les colloïdes sont thermodynamiquement instables ?
Les dispersions colloïdales sont thermodynamiquement instables en raison de leur énergie libre de surface élevée et sont des systèmes irréversibles dans le sens où elles ne sont pas facilement reconstituées après une séparation de phase.
Comment savoir si un produit est cinétique ou thermodynamique ?
Une définition simple est que le produit cinétique est le produit qui se forme plus rapidement, et le produit thermodynamique est le produit qui est plus stable.
Lequel des produits suivants est le carbocation le plus stable ?
Donc $CH_3mathop Climits^ oplus H_2$ est le carbocation le plus stable parmi les carbocations données.
Le contrôle cinétique est-il réversible ?
Contrôle cinétique : Une réaction dans laquelle le rapport des produits est déterminé par la vitesse à laquelle les produits sont formés. Cette réaction E2 est irréversible.
Quelle est la réaction la plus spontanée ?
La plupart des réactions chimiques spontanées sont exothermiques – elles dégagent de la chaleur et réchauffent leur environnement : par exemple : le bois qui brûle, les feux d’artifice et les métaux alcalins ajoutés à l’eau. Lorsqu’un atome radioactif se divise, il libère de l’énergie : c’est une réaction nucléaire spontanée et exothermique.
Pourquoi l’énergie libre de Gibbs est-elle négative ?
L’énergie libre de Gibbs est une quantité dérivée qui mélange les deux grandes forces motrices des processus chimiques et physiques, à savoir la variation d’enthalpie et la variation d’entropie. Si l’énergie libre est négative, nous sommes en présence de changements d’enthalpie et d’entropie qui favorisent le processus et celui-ci se produit spontanément.
Pourquoi une énergie libre de Gibbs négative est-elle spontanée ?
Une combinaison mathématique de la variation d’enthalpie et de la variation d’entropie permet de calculer la variation de l’énergie libre. Une réaction avec une valeur négative de ΔG libère de l’énergie libre et est donc spontanée.