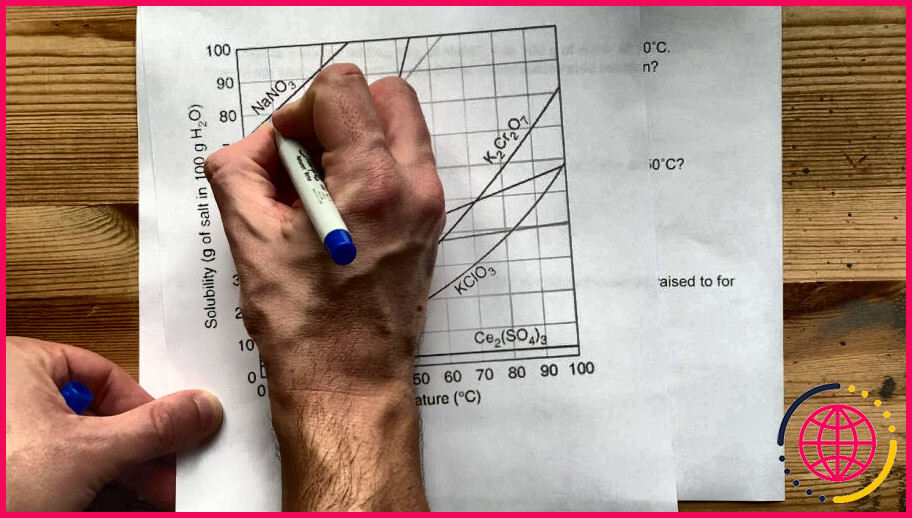
Quel est l’effet de la température sur la solubilité du chlorure de sodium dans l’eau ?
Notez comment la dépendance de la température de NaCl est assez plate, ce qui signifie qu’une augmentation de la température a relativement peu d’ effet sur la solubilité de NaCl . La courbe du KNO 3 , par contre, est très raide et donc une augmentation de la température augmente considérablement la solubilité du KNO 3 .
Sachez aussi, quel est l’effet de la température sur la solubilité du sel dans l’eau ?
La solubilité d’un soluté donné dans un solvant donné dépend généralement de la température . De nombreux sels présentent une forte augmentation de la solubilité avec la température . Certains solutés présentent une solubilité qui est assez indépendante de la température . Quelques-uns, comme le sulfate de cérium(III), deviennent moins solubles dans l’ eau lorsque la température augmente.
A côté de ce qui précède, le chlorure de sodium est-il plus soluble dans l’eau chaude ou froide ? Raison : Le sel se dissoudrait plus rapidement dans l’eau chaude car les molécules de l’eau chaude se déplacent plus rapidement que celles de l’eau froide en raison de l’énergie plus élevée, donc les molécules de l’eau chaude se déplacent rapidement, elles peuvent plus facilement briser les autres molécules d’une substance différente lorsqu’elles entrent en contact.
De même, on se demande pourquoi la solubilité du NaCl n’augmente pas avec la température ?
La solubilité du solide dans un liquide dépend de la nature du solide. Elle dépend du caractère exothermique ou endothermique du processus de dissolution. Par conséquent, la température n’affecte pas t la dissolution du NaCl car la chaleur d’hydratation égale presque la chaleur de dissolution.
Comment détermine-t-on la solubilité ?
La solubilité indique la quantité maximale d’une substance qui peut être dissoute dans un solvant à une température donnée. Une telle solution est dite saturée. Divisez la masse du composé par la masse du solvant, puis multipliez par 100 g pour calculer la solubilité en g/100g .
La PSK augmente-t-elle avec la température ?
Généralement, lorsque la température augmente , alors le produit de solubilité augmente aussi – c’est-à-dire que les choses deviennent plus solubles. Par exemple, considérez certaines des expériences classiques de chimie de cuisine… dissoudre du sel (ou du sucre) dans de l’eau bouillante, continuer à ajouter du sel (ou du sucre) jusqu’à ce qu’il ne se dissolve plus.
Quels sont les 4 facteurs affectant la solubilité ?
Facteurs affectant la solubilité
- La température. Fondamentalement, la solubilité augmente avec la température.
- La polarité. Dans la plupart des cas, les solutés se dissolvent dans des solvants qui ont une polarité similaire.
- La pression. Solutés solides et liquides.
- Taille moléculaire.
- L’agitation augmente la vitesse de dissolution.
La solubilité augmente-t-elle ou diminue-t-elle avec la température ?
Par exemple, le sucre et le sel sont plus solubles dans l’eau à des températures plus élevées. Mais, lorsque la température augmente , la solubilité d’un gaz dans un liquide décroit . Lorsque la température augmente , l’énergie cinétique moyenne des molécules de gaz augmente .
Qu’est-ce qui affecte la solubilité ?
La solubilité est la quantité maximale d’une substance qui se dissout dans une quantité donnée de solvant à une température spécifique. Il existe deux facteurs directs qui affectent la solubilité : la température et la pression. La température affecte la solubilité des solides et des gaz, mais la pression affecte uniquement la solubilité des gaz.
Quel est l’effet de la température sur la solubilité ?
Réponse : Pour de nombreux solides dissous dans de l’ eau liquide, la solubilité augmente avec la température. L’augmentation de l’énergie cinétique qui accompagne les températures élevées permet aux molécules de solvant de briser plus efficacement les molécules de soluté qui sont maintenues ensemble par des attractions intermoléculaires.
Comment la température et la pression affectent-elles la solubilité ?
La solubilité de la plupart des substances dépend fortement de la température et, dans le cas des gaz, de la pression . La solubilité de la plupart des solutés solides ou liquides augmente avec l’accroissement de la température . La solubilité d’un gaz diminue avec l’augmentation de la température .
Pourquoi la solubilité du kno3 augmente-t-elle avec la température ?
A mesure que la température de l’eau augmente , les particules de Nitrate de potassium solide, KNO3 . Les particules qui absorbent l’énergie de leur environnement se déplacent plus facilement entre la solution et l’état solide, car, selon la deuxième loi de la thermodynamique, les particules passent à l’état le plus désordonné
.
La solubilité du NaCl augmente-t-elle avec la température ?
NaCl est inhabituel dans la mesure où sa solubilité ne augmente pas sensiblement avec la température , puisqu’à 100 °C, la solubilité est de 384 mg/mL. 1 La solubilité du NaCl dans l’eau est diminuée par l’ajout de HCl ; il est presque insoluble dans le HCl concentré. La densité d’une solution saturée à 25 C est de 1,202 g/mL.
Pourquoi le NaCl est-il soluble dans le HCl ?
Le chlorure de magnésium et le chlorure de sodium ne sont pas solubles dans l’acide chlorhydrique , à cause de l’effet d’ion commun. En fait, si nous avons une solution saturée de chlorure de sodium et que nous commençons à y ajouter de l’acide chlorhydrique , le chlorure de sodium précipiterait hors de la solution.
Le NaCl peut-il être autoclavé ?
NaCl ( Chlorure de sodium ) Pour préparer une solution 5 M : Dissoudre 292 g de NaCl dans 800 mL de H2O. Ajuster le volume à 1 L avec H2O. Répartir en aliquotes et stériliser par autoclavage .
Le NaCl est-il soluble dans le NaOH ?
Re : NaOH + NaCl Il ne se passe rien chimiquement, mais le NaOH dissous va réduire la quantité de NaCl qui peut se dissoudre en solution (car le NaOH est plus soluble que le NaCl , et il y a un effet d’ion commun avec l’ion sodium).
Pourquoi la température diminue-t-elle lorsque le NaCl est dissous dans l’eau ?
Le processus de dissolution est endothermique lorsque moins d’énergie est libérée lorsque les molécules d’ eau se « lient » au soluté que celle utilisée pour arracher le soluté. Parce que moins d’énergie est libérée que celle utilisée, les molécules de la solution se déplacent plus lentement, ce qui fait que la température diminue .
La masse du NaCl est-elle affectée par sa température ?
Non, la Température n’a aucun effet sur la masse du NaCl s’il est pur et que la température est inférieure à son point d’ébullition. Comme la masse des solides est indépendante de la température . Le point d’ébullition de NaCl s 1413 oC. Si une température supérieure à son point d’ébullition est appliquée, alors il y aura ébullition et la masse de NaCl diminuera.
Comment la pression affecte-t-elle la solubilité ?
Les liquides et les solides ne présentent pratiquement aucun changement de solubilité avec les changements de pression . Les gaz, comme on peut s’y attendre, augmentent leur solubilité avec une augmentation de la pression . La loi de Henry stipule que : La solubilité d’un gaz dans un liquide est directement proportionnelle à la pression de ce gaz au-dessus de la surface de la solution.
Pourquoi la solubilité diminue-t-elle avec l’augmentation de la température ?
Lorsque la température est augmentée , plus d’énergie est donnée au système, qui est utilisée par les molécules de gaz pour surmonter les interactions solvant-gaz et se libérer pour passer à l’état gazeux. Ainsi, la solubilité d’un gaz dans un liquide diminue avec l’augmentation de la température .
Qu’est-ce qu’une solution ?
Une solution est un mélange homogène de deux ou plusieurs substances. Une solution peut exister dans n’importe quelle phase. Une solution est constituée d’un soluté et d’un solvant. Le soluté est la substance qui est dissoute dans le solvant. Par exemple, dans une solution saline, le sel est le soluté dissous dans l’eau comme solvant.
Que se passe-t-il lorsque le sel se dissout dans l’eau ?
Lorsque le sel est mélangé à l’ eau , le sel se dissout car les liaisons covalentes de l’ eau sont plus fortes que les liaisons ioniques des molécules de sel . Les molécules d’ eau écartent les ions sodium et chlorure, brisant ainsi la liaison ionique qui les maintenait ensemble.
La solubilité du NaCl augmente-t-elle avec la température ?","acceptedAnswer": {"@type": "Answer","text": "NaCl est inhabituel dans la mesure où sa solubilité ne augmente pas sensiblement avec la température, puisqu'à 100 °C, la solubilité est de 384 mg/mL. 1 La solubilité du NaCl dans l'eau est diminuée par l'ajout de HCl ; il est presque insoluble dans le HCl concentré. La densité d'une solution saturée à 25 C est de 1,202 g/mL. " } }, {"@type": "Question","name": "Pourquoi le NaCl est-il soluble dans le HCl ?","acceptedAnswer": {"@type": "Answer","text": "Le chlorure de magnésium et le chlorure de sodium ne sont pas solubles dans l'acide chlorhydrique, à cause de l'effet d'ion commun. En fait, si nous avons une solution saturée de chlorure de sodium et que nous commençons à y ajouter de l'acide chlorhydrique, le chlorure de sodium précipiterait hors de la solution." } }, {"@type": "Question","name": "Le NaCl peut-il être autoclavé ?","acceptedAnswer": {"@type": "Answer","text": "NaCl (Chlorure de sodium) Pour préparer une solution 5 M : Dissoudre 292 g de NaCl dans 800 mL de H2O. Ajuster le volume à 1 L avec H2O. Répartir en aliquotes et stériliser par autoclavage." } }, {"@type": "Question","name": "Le NaCl est-il soluble dans le NaOH ?","acceptedAnswer": {"@type": "Answer","text": "Re : NaOH + NaCl Il ne se passe rien chimiquement, mais le NaOH dissous va réduire la quantité de NaCl qui peut se dissoudre en solution (car le NaOH est plus soluble que le NaCl, et il y a un effet d'ion commun avec l'ion sodium)." } }, {"@type": "Question","name": "Pourquoi la température diminue-t-elle lorsque le NaCl est dissous dans l'eau ?","acceptedAnswer": {"@type": "Answer","text": "Le processus de dissolution est endothermique lorsque moins d'énergie est libérée lorsque les molécules d'eau se "lient" au soluté que celle utilisée pour arracher le soluté. Parce que moins d'énergie est libérée que celle utilisée, les molécules de la solution se déplacent plus lentement, ce qui fait que la température diminue." } }, {"@type": "Question","name": "La masse du NaCl est-elle affectée par sa température ?","acceptedAnswer": {"@type": "Answer","text": "Non, la Température n'a aucun effet sur la masse du NaCl s'il est pur et que la température est inférieure à sonpoint d'ébullition. Comme la masse des solides est indépendante de la température. Le point d'ébullition de NaCl s 1413 oC. Si une température supérieure à son point d'ébullition est appliquée, alors il y aura ébullition et la masse de NaCl diminuera." } }, {"@type": "Question","name": "Comment la pression affecte-t-elle la solubilité ?","acceptedAnswer": {"@type": "Answer","text": "Les liquides et les solides ne présentent pratiquement aucun changement de solubilité avec les changements de pression. Les gaz, comme on peut s'y attendre, augmentent leur solubilité avec une augmentation de la pression. La loi de Henry stipule que : La solubilité d'un gaz dans un liquide est directement proportionnelle à la pression de ce gaz au-dessus de la surface de la solution." } }, {"@type": "Question","name": "Pourquoi la solubilité diminue-t-elle avec l'augmentation de la température ?","acceptedAnswer": {"@type": "Answer","text": "Lorsque la température est augmentée, plus d'énergie est donnée au système, qui est utilisée par les molécules de gaz pour surmonter les interactions solvant-gaz et se libérer pour passer à l'état gazeux. Ainsi, la solubilité d'un gaz dans un liquide diminue avec l'augmentation de la température." } }, {"@type": "Question","name": "Qu'est-ce qu'une solution ?","acceptedAnswer": {"@type": "Answer","text": "Une solution est un mélange homogène de deux ou plusieurs substances. Une solution peut exister dans n'importe quelle phase. Une solution est constituée d'un soluté et d'un solvant. Le soluté est la substance qui est dissoute dans le solvant. Par exemple, dans une solution saline, le sel est le soluté dissous dans l'eau comme solvant." } }] }