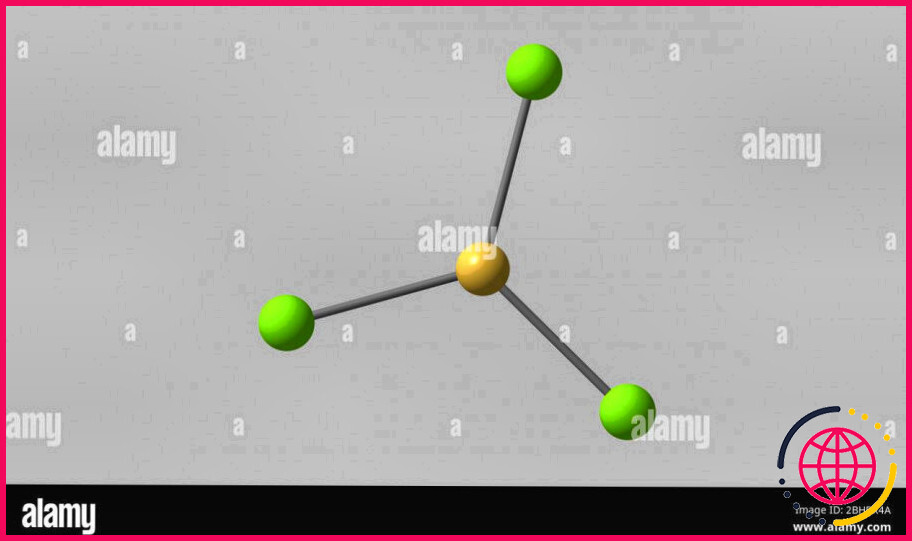
Quelle est la formule du trichlorure de bore ?
BCl3
Les gens demandent aussi, le trichlorure de bore est-il un composé ?
Le trichlorure de bore est le composé inorganique de formule BCl3. Ce gaz incolore est un réactif en synthèse organique. Il est très réactif vis-à-vis de l’eau
.
Par ailleurs, le trichlorure de bore est-il polaire ou non polaire ? La géométrie moléculaire du BCl3 est trigonal planaire avec une distribution symétrique des charges autour de l’atome central. Par conséquent, cette molécule est non polaire . Trichlorure de bore sur Wikipédia.
Par ailleurs, combien d’électrons de valence possède le trichlorure de bore ?
six électrons de valence
Quel est le type de liaison du trichlorure de bore ?
Il s’ensuit donc qu’un atome aura tendance à faire autant de liaisons covalentes que possible. Dans le cas du bore dans BF3, trois liaisons est le maximum possible car le bore n’a que 3 électrons à partager. Vous pouvez peut-être vous demander pourquoi le bore ne forme pas des liaisons ioniques avec le fluor à la place.
A quoi sert le trifluorure de bore ?
Le trifluorure de bore est un gaz incolore, à l’odeur forte, qui forme des fumées denses et blanches dans l’air humide. Il est utilisé comme catalyseur des réactions de polymérisation, dans les flux de soudure et les fibres optiques, et comme agent extincteur du magnésium.
Pourquoi le BCl3 réagit-il avec l’eau ?
BCl3 est une molécule déficiente en électrons . elle accepte facilement une paire d’électrons de eau et donc, BCl3 subit une hydrolyse pour former de l’acide borique (H3BO3) et du HCl. ainsi, CCl4 ne subit pas d’hydrolyse dans eau .
Pourquoi le BCl3 a-t-il une forme plane trigonale ?
BCl3 possède 3 liaisons simples B-Cl et aucune paire solitaire autour de B, donc 6 électrons de valence autour de B. Selon la notation VSEPR, cette molécule prend la notation AX3. La géométrie de BCl3 est planaire trigone . AlCl3 a 3 liaisons simples Al-Cl et aucune paire solitaire autour de Al, donc 6 électrons de valence autour de Al.
Le BCl3 est-il un acide ou une base de Lewis ?
Explication : La théorie des acides de Lewis – bases définit les acides comme des espèces acceptant des paires d’électrons. L’atome de bore central du trichlorure de bore BCl3 est déficient en électrons, ce qui permet à la molécule d’accepter des paires d’électrons supplémentaires et d’agir comme un acide de Lewis .
Quel est le nom du composé BCl3 ?
trichlorure de bore
Le bore forme-t-il des liaisons ioniques ?
Le bore est un métalloïde, intermédiaire entre les métaux et les non-métaux. Il existe sous de nombreux polymorphes (différentes structures de réseau cristallin), certains plus métalliques que d’autres. Le bore métallique est extrêmement dur et a un point de fusion très élevé. Le bore ne fait généralement pas de liaisons ioniques , il forme des liaisons covalentes stables .
Le BCl3 a-t-il une charge formelle ?
Donc une charge formelle de zéro. Pour le brome ici, on a 3 moins zéro moins 6 sur 2 ; 3 moins 3 nous donne zéro. Donc la charge formelle du brome est de zéro.
Le cbr4 est-il inflammable ?
Le tétrabromure de carbone est une substance non inflammable .
Le bore suit-il la règle de l’octet ?
Moins d’un Octet [edit] Les autres exceptions notables sont l’aluminium et le bore , qui peuvent bien fonctionner avec six électrons de valence. Le boron partage ses trois électrons avec trois atomes de fluor. Les atomes de fluor suivent la règle de l’octuor , mais le bore n’a que six électrons.
Pourquoi le bore ne possède-t-il que 6 électrons ?
Cependant, la seule facette d’un atome qui dicte quoi que ce soit sur le nombre d’ électrons de valence est sa charge nucléaire.
Pourquoi bf3 ne suit-il pas la règle de l’octet ?
Le bore ne fait couramment que trois liaisons covalentes, ce qui se traduit par seulement six électrons de valence autour de l’atome B. Un exemple bien connu est BF 3 : La troisième violation à la règle de l’octet se trouve dans les composés avec plus de huit électrons assignés à leur coquille de valence.
Comment détermine-t-on la polarité ?
Etape 2 : Identifiez chaque liaison comme étant soit polaire , soit non polaire. (Si la différence d’électronégativité des atomes d’une liaison est supérieure à 0,4, on considère la liaison polaire . Si la différence d’électronégativité est inférieure à 0,4, la liaison est essentiellement non polaire). S’il n’y a pas de liaisons polaires , la molécule est non polaire.
Quelle est la structure de Lewis pour nf3 ?
La structure de Lewis du
NF 3 (trifluorure d’azote) est très similaire à celle du NCl3 et du NH3. Dans la structure de Lewis NF 3 (et toutes les structures), l’hydrogène va à l’extérieur. L’hydrogène n’a besoin que de deux électrons de valence pour avoir une coquille extérieure complète. Dans la structure de Lewis de NF 3, il y a un total de 8 électrons de valence.
Quelle est la structure de Lewis pour no2 ?
La structure de Lewis de NO2 comporte un total de 17 électrons de valence. Il n’est pas courant d’avoir un nombre impair d’électrons de valence dans une structure de Lewis . Pour cette raison, nous allons essayer de nous rapprocher le plus possible d’un octuor sur l’atome central d’azote (N). Cela signifie qu’il n’aura que 7 électrons de valence.
Pourquoi existe-t-il des octets incomplets ?
Il y a sont certains atomes de certains éléments qui peuvent exister dans des composés stables formant des liaisons avec moins de huit électrons de valence. Lorsque cela se produit, on dit que l’atome de l’élément dans la molécule est contient un octet incomplet . L’hydrogène fait une liaison (groupe 1).
Pourquoi le bf3 est-il réactif ?
BF3 est communément appelé « déficient en électrons » en raison de sa réactivité exothermique envers les bases de Lewis. BF3 est fabriqué par la réaction d’oxydes de bore avec du fluorure d’hydrogène. Le trifluorure de bore étant corrosif, les métaux adaptés à la manipulation du trifluorure de bore sont l’acier inoxydable, le monel et l’hastelloy.
Combien de paires solitaires y a-t-il dans le BCl3 ?
Réponse et explication: Il n’y a pas de paires solitaires dans l’atome central du trichlorure de bore car c’est l’une des exceptions de la règle de l’octuor.
La structure de Lewis du","acceptedAnswer": {"@type": "Answer","text": "NF3 (trifluorure d'azote) est très similaire à celle du NCl3 et du NH3. Dans la structure de Lewis NF3 (et toutes les structures), l'hydrogène va à l'extérieur. L'hydrogène n'a besoin que de deux électrons de valence pour avoir une coquille extérieure complète. Dans la structure de Lewis de NF3, il y a un total de 8 électrons de valence." } }, {"@type": "Question","name": "Quelle est la structure de Lewis pour no2 ?","acceptedAnswer": {"@type": "Answer","text": "La structure de Lewis de NO2 comporte un total de 17 électrons de valence. Il n'est pas courant d'avoir un nombre impair d'électrons de valence dans une structure de Lewis. Pour cette raison, nous allons essayer de nous rapprocher le plus possible d'un octuor sur l'atome central d'azote (N). Cela signifie qu'il n'aura que 7 électrons de valence." } }, {"@type": "Question","name": "Pourquoi existe-t-il des octets incomplets ?","acceptedAnswer": {"@type": "Answer","text": "Il y a sont certains atomes de certains éléments qui peuvent exister dans des composés stables formant des liaisons avec moins de huit électrons de valence. Lorsque cela se produit, on dit que l'atome de l'élément dans la molécule estcontient un octet incomplet. L'hydrogène fait une liaison (groupe 1)." } }, {"@type": "Question","name": "Pourquoi le bf3 est-il réactif ?","acceptedAnswer": {"@type": "Answer","text": "BF3 est communément appelé "déficient en électrons" en raison de sa réactivité exothermique envers les bases de Lewis. BF3 est fabriqué par la réaction d'oxydes de bore avec du fluorure d'hydrogène. Le trifluorure de bore étant corrosif, les métaux adaptés à la manipulation du trifluorure de bore sont l'acier inoxydable, le monel et l'hastelloy." } }] }