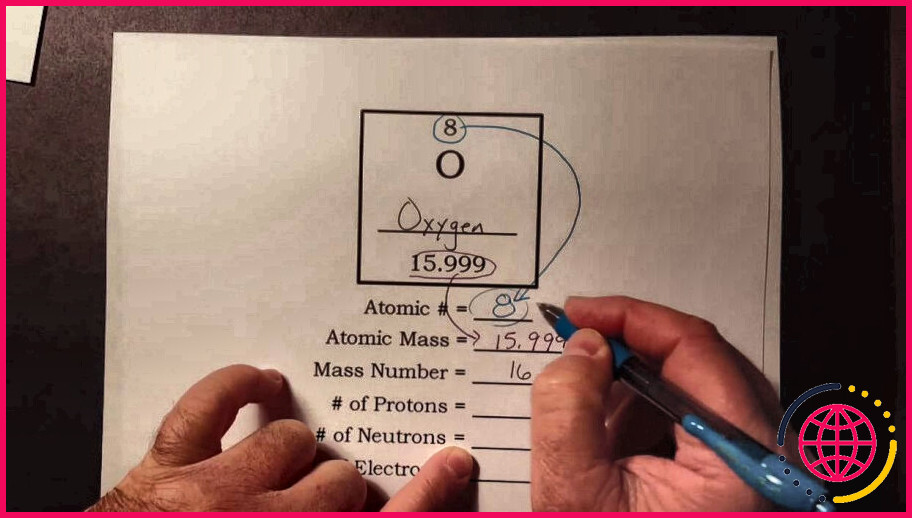
Quelle est la masse sur le tableau périodique ?
La masse atomique standard est la masse moyenne d’un élément en unités de masse atomique (« amu »). Bien que les atomes individuels aient toujours un nombre entier d’unités de masse atomique, la masse atomique sur le tableau périodique est indiquée comme un nombre décimal parce qu’elle est une moyenne des différents isotopes d’un élément .
De même on peut se demander comment trouver la masse atomique sur le tableau périodique ?
Pour calculer la masse atomique d’un seul atome d’un élément, il faut additionner les masses des protons et des neutrons. Exemple : Trouver la masse atomique d’un isotope du carbone qui possède 7 neutrons. Vous pouvez voir sur le tableau périodique que le carbone a un nombre atomique de 6, qui est son nombre de protons.
Par la suite, la question est de savoir quel est le numéro de masse des 20 premiers éléments ? Chimie : Liste des éléments du tableau périodique triée par : Numéro atomique
| No. | Atomic Weight | Name |
|---|---|---|
| 17 | 35.453 | Chlorine |
| 18 | 39.948 | Argon |
| 19 | 39.098 | Potassium |
| 20 | 40.078 | Calcium |
De même, quel élément du tableau périodique a la plus grande masse ?
l’uranium
Quel élément a une masse de 18 ?
Les éléments du tableau périodique triés par masse atomique.
| Atomic Mass | Name chemical element | number |
|---|---|---|
| 32.065 | Sulfur | 16 |
| 35.453 | Chlorine | 17 |
| 39.0983 | Potassium | 19 |
| 39.948 | Argon | 18 |
La masse atomique et le numéro de masse sont-ils identiques ?
La masse atomique est la moyenne pondérée de la masse d’un atome d’un élément en fonction de l’abondance naturelle relative des isotopes de cet élément. Le nombre de masse est un compte du nombre total de protons et de neutrons dans le noyau d’un atome .
Qu’est-ce que le numéro de masse atomique ?
Le nombre de masse (symbole A, du mot allemand Atomgewicht [ atomic weight]), également appelé nombre de masse atomique ou nombre de nucléons , est le nombre total de protons et de neutrons (appelés ensemble nucléons) dans un noyau atomique . Le nombre de masse est différent pour chaque isotope différent d’un élément chimique.
Qu’est-ce qui a une masse de 1 amu ?
Une unité de masse atomique (symbolisée UMA ou amu) est définie comme étant précisément 1/12 de la masse d’un atome de carbone-12. L’atome de carbone-12 (C-12) possède six protons et six neutrons dans son noyau. En termes imprécis, une UAM est la moyenne de la masse au repos du proton et de la masse au repos du neutron .
Comment la masse atomique est-elle mesurée ?
La masse atomique d’un élément est la moyenne de la masse des atomes d’un élément mesuré en unité de masse atomique (amu, également appelée daltons, D). La masse atomique est une moyenne pondérée de tous les isotopes de cet élément, dans laquelle la masse de chaque isotope est multipliée par l’abondance de cet isotope particulier.
Comment calcule-t-on la masse ?
Divisez le poids de l’objet par l’accélération de la gravité pour trouver la masse . Vous devrez convertir les unités de poids en newtons. Par exemple, 1 kg = 9,807 N. Si vous mesurez la masse d’un objet sur Terre, divisez le poids en Newtons par l’accélération de la gravité sur Terre (9,8 mètres/seconde2) pour obtenir la masse .
Que représente la masse atomique dans le tableau périodique ?
Ces deux nombres sont fixés pour un élément . Le nombre de masse nous indique le nombre (la somme des nucléons) de protons et de neutrons dans le noyau d’un atome . Le numéro atomique (également connu sous le nom de nombre de protons) est le nombre de protons trouvés dans le noyau d’un atome . Elle est traditionnellement représentée par le symbole Z.
Pourquoi la masse atomique est-elle une décimale ?
Bien que les atomes individuels aient toujours un nombre entier d’unités de masse atomique , la masse atomique du tableau périodique est énoncée comme un nombre décimal parce qu’il s’agit d’une moyenne des différents isotopes d’un élément.
Qu’est-ce que la masse atomique relative en chimie ?
Une masse atomique relative (également appelée poids atomique ; symbole : Ar) est une mesure de la lourdeur des atomes . Il s’agit du rapport entre la masse moyenne par atome d’un élément d’un échantillon donné et 1/12 de la masse .
d’un atome de carbone-12. Cependant, la plupart des éléments dans la nature sont constitués de atomes avec différents nombres de neutrons.
Quel est l’élément le plus grand ?
Ce tableau périodique montre les tailles relatives des atomes de chaque élément . La taille de chaque atome est relative à l’élément le plus grand , le césium.
Quel est le métal le plus lourd sur terre ?
Osmium
Quel est l’élément le plus petit ?
Hydrogène
Quel est le gaz le plus lourd ?
Radon
Quel élément a une masse atomique de 27 ?
Cobalt
L’uranium est-il l’élément le plus lourd ?
L’ élément le plus lourd connu dans la nature est l’uranium , qui ne contient que 92 protons, ce qui le place 30 places en dessous du nouvel élément putatif du tableau périodique. En laboratoire, les physiciens ont réussi à créer des éléments jusqu’à 118, mais ils sont tous très instables.
L’uranium est-il plus lourd que l’or ?
L’osmium et l’iridium sont des matériaux très denses ~22,6 g/cm3 — environ 20 fois plus lourds que le même volume d’eau et environ 10% plus denses que le plutonium. Ils sembleraient être plus lourds , mais les atomes sont en fait plus légers. Réponse 4 : L’élément le plus lourd communément trouvé dans la nature est l’uranium , bien que le plutonium soit plus lourd .
Quelle est la substance la plus lourde ?
L’osmium est l’une des matières les plus lourdes sur terre, pesant deux fois plus que le plomb par cuillère à café. L’osmium est un élément chimique des métaux du groupe du platine ; il est souvent utilisé comme alliage dans les contacts électriques et les plumes de stylo-plume.
Quel est l’élément stable le plus lourd ?
uranium