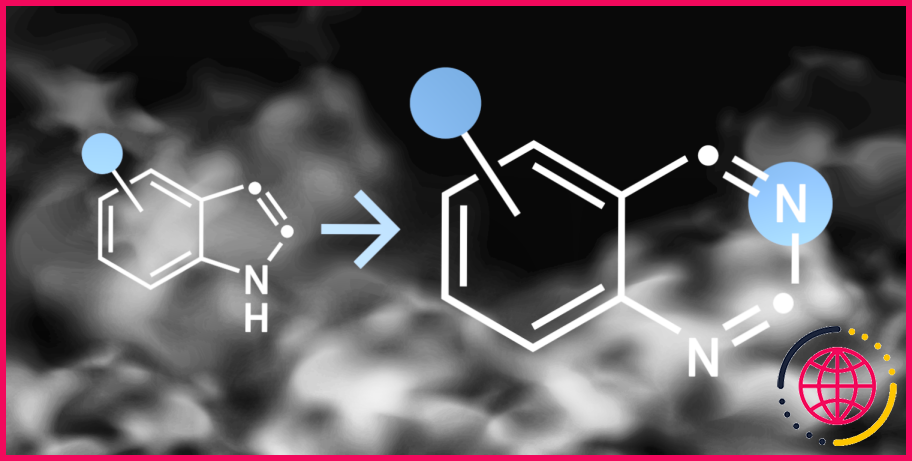
Quelle est la réaction de réarrangement de Schmidt ?
Le réarrangement de Schmidt est une réaction chimique dans laquelle un alcène est réarrangé en une cétone. La réaction porte le nom du chimiste allemand Heinrich Schmidt qui a décrit la réaction pour la première fois en 1885.
La réaction de Schmidt est une réaction organique dans laquelle un azide réagit avec un dérivé carbonyle, généralement un aldéhyde, une cétone ou un acide carboxylique, dans des conditions acides pour donner une amine ou un amide, avec expulsion de l’azote.
Qu’est-ce que le réarrangement de Schmidt ?
Les réactions de Schmidt désignent les réactions catalysées par les acides de l’acide hydrazoïque avec des électrophiles, tels que les composés carbonylés, les alcools tertiaires et les alcènes. Ces substrats subissent un réarrangement et une extrusion de l’azote pour fournir des amines, des nitriles, des amides ou des imines.
Quel intermédiaire est formé dans la réaction de réarrangement de Schmidt ?
On a montré qu’un intermédiaire dans le réarrangement de Schmidt est un azide d’acyle, et l’isocyanate intermédiaire n’est généralement pas isolé dans ces conditions.
Quel réactif est utilisé pour la réaction de Schmidt ?
La réaction de Schmidt[1]est une réaction organique impliquant une migration alkyle/aryle sur la liaison carbone-azote d’un azide avec expulsion de l’azote. Un réactif clé introduisant ce groupe azide est l’acide hydrazoïque, et le ou les produits de la réaction dépendent de la nature du substrat.
Quelle est la réaction de réarrangement de Curtius ?
Le réarrangement de Curtius est une réaction polyvalente dans laquelle un acide carboxylique peut être converti en un isocyanate par l’intermédiaire d’un azide d’acyle dans des conditions douces. L’isocyanate stable résultant peut ensuite être facilement transformé en une variété d’amines et de dérivés d’amines, y compris les uréthanes et les urées.
Qu’appelle-t-on réarrangement de Cope ?
Le réarrangement de Cope est l’isomérisation thermique d’un 1,5-diène conduisant à un 1,5-diène régioisomère. Le produit principal est le régioisomère thermodynamiquement plus stable. L’Oxy-Cope a un substituant hydroxyle sur un sp3-de l’isomère de départ.
Le produit de départ est-il utilisé dans la réaction de Claisen-Schmidt ?
Le catalyseur basique le plus utilisé est le NaOH en raison de son meilleur rendement.[4]. Certains catalyseurs de base qui ont été utilisés dans la réaction de Claisen-Schmidt sont KOH (rendement 88-94%).[5], Ba(OH)2 (rendement 88-98%)[6], NaOH (rendement 90-96%)[7].
Qu’est-ce que la réaction de Claisen-Schmidt ?
La réaction de condensation de Claisen-Schmidt est une réaction organique dans laquelle une cétone ou un aldéhyde détenant un α-hydrogène réagit avec un composé carbonyle aromatique qui ne possède pas d’α-hydrogène. Cette réaction porte le nom des chimistes J.G. Schmidt et Rainer Ludwig Claisen.
Que signifie le réarrangement de Beckmann ?
Le réarrangement de Beckmann, nommé d’après le chimiste allemand Ernst Otto Beckmann (1853-1923), est un réarrangement d’un groupe fonctionnel oxime en amides substitués. Certaines conditions sont connues pour racémiser la géométrie de l’oxime, conduisant à la formation des deux régioisomères.
Quel est le but de la condensation aldol ?
La condensation d’Aldol peut être définie comme une réaction organique dans laquelle l’ion énolate réagit avec un composé carbonyle pour former une β-hydroxy cétone ou un β-hydroxy aldéhyde, suivie d’une déshydratation pour donner une énone conjuguée. La condensation aldol joue un rôle essentiel dans la synthèse organique, en créant une voie pour former des liaisons carbone-carbone.
Qu’est-ce que la réaction de Smit ?
Réaction, catalysée par un acide, de l’azoture d’hydrogène avec des électrophiles, tels que des composés carbonylés, des alcools tertiaires ou des alcènes. Après un réarrangement et une extrusion du N2, on obtient des amines, des nitriles, des amides ou des imines.
Qu’est-ce qu’une réaction de réarrangement avec un exemple ?
Qu’est-ce que la réaction de réarrangement avec exemple ? Habituellement, les alcanes à chaîne droite sont convertis par chauffage en présence d’un catalyseur en isomères ramifiés. Par exemple, l’isomérisation du n-butane en isobutane et du pentane en isopentane.
Pourquoi l’azoture est-il explosif ?
Le 1-Diazidocarbamoyl-5-azidotetrazole, appelé de manière informelle « azidoazide azide », est un composé organique hétérocyclique bourré de 14 atomes d’azote. En raison du grand nombre de liaisons d’azote à haute énergie, le composé est extrêmement explosif.
Qu’est-ce que la technique de Schotten Baumann ?
La réaction de Schotten Baumann désigne la méthode de synthèse chimique des amides à partir de chlorures d’acyle et d’amines. Cette réaction de chimie organique porte le nom des chimistes allemands Carl Schotten et Eugen Baumann, qui ont découvert cette méthode de synthèse des amides.
Quel réactif est utilisé pour le réarrangement de Hofmann ?
Les réarrangements de Hofmann peuvent être réalisés sur des amides primaires aliphatiques en utilisant des réactifs à base d’iode hypervalent.
Pourquoi le réarrangement de Pinacol est-il favorable ?
La force motrice de cette étape de réarrangement serait la stabilité relative de l’ion oxonium résultant. Bien que le carbocation initial soit déjà tertiaire, l’oxygène peut stabiliser la charge positive beaucoup plus favorablement en raison de la configuration complète en octuor à tous les centres.
Quel carbocation intermédiaire est plus stable dans le réarrangement de Pinacol ?
Le 3º-carbocation résultant est relativement stable, et il a été démontré qu’il retourne au pinacol par réaction en présence d’eau marquée isotopiquement. Un déplacement 1,2-méthyle génère un carbocation encore plus stable dans lequel la charge est délocalisée par résonance d’hétéroatome.
Quel type de réaction est la condensation d’aldol ?
Dans une condensation aldol, un ion énolate réagit avec un composé carbonyle en présence d’un catalyseur acide/base pour former un β-hydroxy aldéhyde ou une β-hydroxy cétone, suivi d’une déshydratation pour donner une énone conjuguée. C’est une réaction utile de formation de liaisons carbone-carbone.
Qu’est-ce que ENOL et Enolate ?
Les énols peuvent être considérés comme des alcènes avec un substituant fort donneur d’électrons. Les énolates sont les bases conjuguées ou les anions des énols (comme les alcoxydes sont les anions des alcools) et peuvent être préparés en utilisant une base.
Qu’est-ce que la réaction de Finkelstein donnez un exemple ?
Réaction de Finkelstein : Un SN2 dans laquelle un atome d’halogène (le groupe partant) est remplacé par un autre atome d’halogène (le nucléophile). Dans cet exemple de réaction de Finkelstein, le 1-chloro-2-phényléthane (un halogénure d’alkyle primaire) est traité avec de l’iodure de sodium (le nucléophile) pour produire du 1-iodo-2-phényléthane.
Qu’est-ce que la réaction de Sandmeyer et Gattermann ?
Ainsi, la différence essentielle entre la réaction de Sandmeyer et la réaction de Gattermann est que la réaction de Sandmeyer se réfère à la synthèse d’halogénures d’aryle à partir de sels d’aryl diazonium en présence de sels de cuivre comme catalyseur, tandis que la réaction de Gattermann se réfère à la formylation de composés aromatiques en présence d’un Lewis .
Qu’est-ce que la réaction de Gattermann-Koch ?
: une synthèse d’un aldéhyde à partir d’un hydrocarbure aromatique, de monoxyde de carbone, de chlorure d’hydrogène et d’un catalyseur contenant du chlorure d’aluminium.