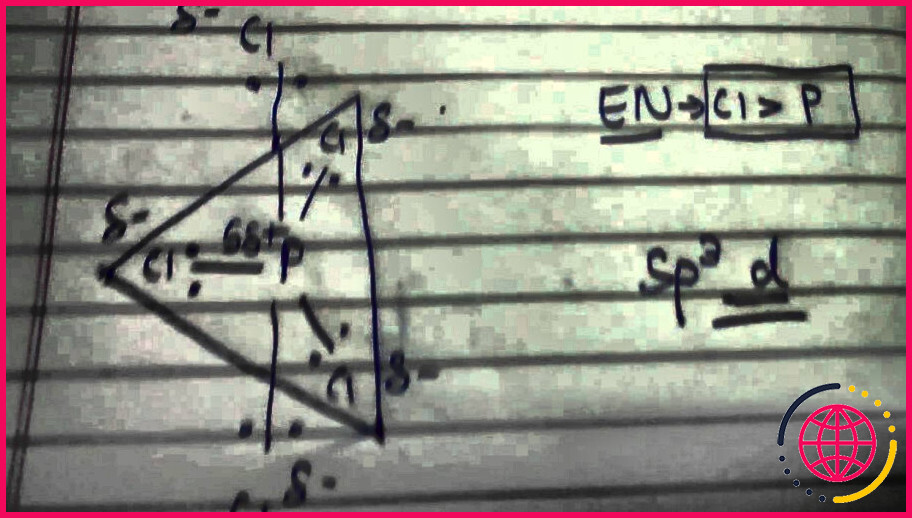
Quelle est l’hybridation dans pcl5 ?
L’ hybridation de P dans PCl5 est sp3d. L’atome P a besoin de cinq orbitales pour former les cinq liaisons P-Cl . Il possède une orbitale 3s et trois orbitales 3p, il doit donc utiliser une de ses orbitales 3d pour former la cinquième liaison.Ces orbitales sont hybridées pour former cinq orbitales sp3d et forment ainsi une bipyramide trigonale.
Simplement, quelle est l’hybridation de PCl3?
Structure de PCl3 . Comme hybridation est égale à la somme des liaisons sigma +nombre de paires solitaires. Donc dans PCl3 nous avons 3 liaisons sigma(P-Cl )et une paire solitaire donc total 4, donc l’hybridation est sp3. La molécule PCl3 une géométrie ou forme pyramidale trigonale.
De même, quelle est la géométrie de PCl5 ? La géométrie moléculaire de PCl5 est trigonale bipyramide avec une distribution symétrique de la région électronique autour de l’atome central. Par conséquent, cette molécule est non polaire. Pentachlorure de phosphore sur Wikipédia.
Par la suite, on peut aussi se demander quelle est l’hybridation de l’atome central dans la molécule de pentachlorure de phosphore PCl5.
sp3d et sp3d2 Hybridation Dans une molécule de pentachlorure de phosphore , PCl5, il y a cinq liaisons P-Cl (donc cinq paires d’électrons de valence autour de l’atome de phosphore ) dirigées vers les coins d’une bipyramide trigonale.
Combien de paires solitaires y a-t-il dans le PCl5 ?
Avec cinq paires de liaison et une paire solitaire , le BrF 5 est désigné comme AX 5E ; il possède au total six paires d’électrons. La structure BrF 5 a quatre atomes de fluor dans un plan en position équatoriale et un atome de fluor et la seule paire d’électrons dans les positions axiales.
Le XeF4 est-il planaire ?
La structure VSEPR de XeF4 est carrée planaire . C’est un octaèdre mais à cause des paires solitaires, cela dicte qu’il y a 6 domaines autour de l’atome central et la théorie VSEPR affirme que toute espèce AX4E2 avec 2 paires solitaires est carrée planaire .
Quelle est l’hybridation du XeF4 ?
Dans XeF4 , l’atome central Xe est hybridé sp3d2 ayant 2 paires solitaires sur lui donc la forme de la molécule sera carrée plane. Vous pouvez calculer son hybridation en utilisant une méthode simple, Dans l’éthène CH2=CH2 l’atome de carbone forme 3 liaisons sigma, deux avec l’hydrogène et une avec le carbone donc son hybridation sera sp2.
Quelle est l’hybridation de l’h2o ?
H2O possède 2(1) + 6 = 8 électrons de valence. H2O a un arrangement tétraédrique des paires d’électrons autour de l’atome O qui nécessite une hybridation sp3 . Deux des quatre orbitales hybrides sp3 sont utilisées pour former des liaisons avec les deux atomes d’hydrogène, et les deux autres orbitales hybrides sp3 maintiennent les deux paires solitaires sur l’oxygène.
Le PCl5 est-il planaire ?
Dans PCl5 , les trois liaisons P- Cl en plan sont dites as. Pour les molécules adoptant une géométrie bipyramidale trigonale, il y a 5 liaisons. Les trois liaisons dans le plan appelées liaisons planaires ou liaisons équatoriales. Et les deux autres liaisons – l’une située au-dessus du plan et l’autre au-dessous du plan appelées liaisons axiales.
Quel est l’ordre des liaisons du PCl5 ?
He2 h2 ordre de liaison 2 1 /2 1/2. formation de 5 p cl sigma liaisons dirigées vers les cœurs d’une structure bipyramidale trigonale régulière. ainsi, la géométrie de la molécule pcl5 peut être montrée comme . 7 pour le benzène, charge formelle sur le carbone zéro c c ordre de liaison 1 1/2 3/2.
Quelle est l’hybridation de la coh2 ?
Réponse et explication: Le carbone central du formaldéhyde a une hybridation sp2. Le formaldéhyde est une molécule avec un seul carbone, atome central avec des liaisons simples à deux
.
Combien de paires solitaires y a-t-il dans le PCl3 ?
Six des électrons sont attachés dans les liaisons covalentes P-Cl, les deux électrons restants sont une paire solitaire sur le phosphore. Un calcul similaire révèle que chaque Cl possède 3 paires solitaires .
Quelle est l’hybridation de bcl3 ?
L’ hybridation dans le trichlorure de bore est une hybridation sp2 . Cela explique l’aptitude du bore à se lier à trois autres atomes et à avoir une géométrie moléculaire planaire trigonale alors qu’il n’a qu’une orbitale p partiellement remplie capable d’établir une liaison.
Le PCl3 est-il tétraédrique ?
La forme d’une molécule de P C l 3 PCl_3 PCl3 est pyramidale trigonale. L’atome central P possède une paire d’électrons solitaires et trois paires d’électrons de liaison. Il subit une hybridation s p 3 displaystyle sp^3 sp3 qui donne lieu à une géométrie tétraédrique de paires d’électrons et à une géométrie moléculaire pyramidale trigonale.
BrF3 est-il polaire ou non polaire ?
Est-ce que BrF3 est polaire ou non polaire ? BrF3, ou trifluorure de brome, est un solvant auto-ionisant hautement polaire. Ce composé est un agent de fluoration puissant, avec un moment dipolaire de 1,19 D et une constante diélectrique très élevée de 107 à 25 °C.
Le XeF4 est-il polaire ou non polaire ?
XeF4 Polarité – Le XeF4 est-il polaire ou non polaire ? Comme nous pouvons le voir, la géométrie moléculaire du XeF4 a la distribution symétrique des électrons et ils font une formation dans le plan carré unique. Donc, nous pouvons dire que le XeF4 est nonpolaire .
Quelle est l’hybridation du PCl5 ?
La hybridation de P dans PCl5 est sp3d. L’atome P a besoin de cinq orbitales pour former les cinq liaisons P-Cl . Il possède une orbitale 3s et trois orbitales 3p, il doit donc utiliser une de ses orbitales 3d pour former la cinquième liaison.Ces orbitales sont hybridées pour former cinq orbitales sp3d et forment ainsi une bipyramide trigonale.
Peut-on fabriquer du PCl3 ?
Le trichlorure de phosphore est préparé industriellement par réaction du chlore avec une solution de phosphore blanc à reflux dans du trichlorure de phosphore, avec élimination continue du PCl3 au fur et à mesure de sa formation.
Le PCl3 est-il dipôle ?
(a) PCl3 est polaire alors que PCl5 est non polaire. A ce titre, les seules forces intermoléculaires actives dans le PCl5 sont des forces dipôle induites (forces de dispersion de London). Dans PCl3 , il existe également des forces dipôle – dipôle et des forces dipôle -induites dipôle .
Quel est le nom du PCl5 ?
Chlorure de phosphore(V) Pentachlorure de phosphore
.
Le PCl5 est-il une molécule polaire ou non polaire ?
Le composé chimique pentachlorure de phosphore, qui a pour formule chimique PCl5 , est une molécule non polaire . La géométrie moléculaire du pentachlorure de phosphore est symétrique, ce qui neutralise les dipôles de liaison de la molécule pour la rendre non polaire .
Comment se forme le PCl5 ?
Le pentachlorure de phosphore est préparé en faisant passer un excès de chlore sec dans du trichlorure liquide. Le chlore réagit avec le trichlorure de phosphore et le pentachlorure de phosphore solide est formé .