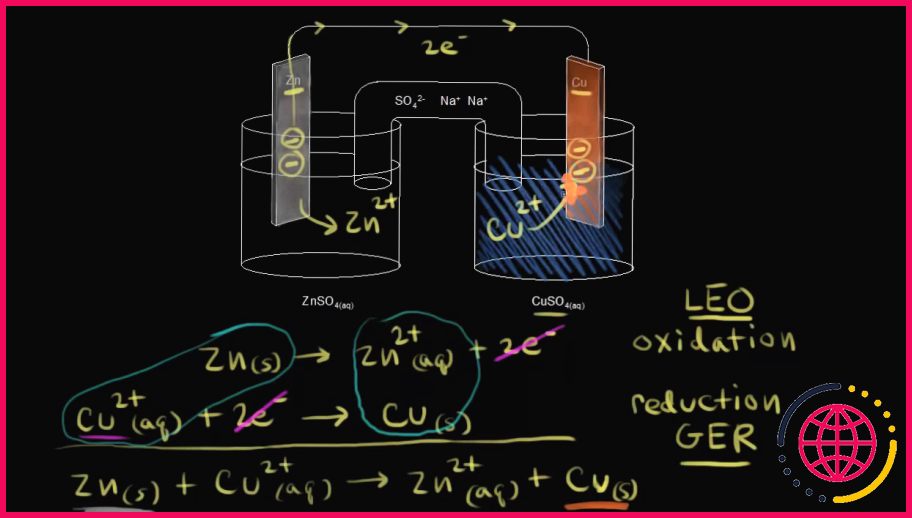
Quelles réactions se produisent à l’anode dans une pile voltaïque ?
Une électrode est une bande de métal sur laquelle la réaction a lieu. Dans une pile voltaïque, l’ oxidation et la réduction des métaux se produisent aux électrodes. Il y a deux électrodes dans une pile voltaïque, une dans chaque demi-cellule. La cathode est l’endroit où la réduction a lieu et la oxidation a lieu à l’anode.
En conséquence, quelle demi-réaction peut se produire à l’anode dans une cellule voltaïque ?
La demi-réaction à l’anode, où se produit la oxidation , est Zn(s) = Zn2+ (aq) + (2e-). Le zinc perd deux électrons pour former Zn2+. La demi-réaction sur la cathode où la réduction se produit est Cu2+ (aq) + 2e- = Cu(s). Ici, les ions cuivre gagnent des électrons et deviennent du cuivre solide.
En outre, pourquoi l’anode est-elle négative dans une pile voltaïque ?
L’ anode est l’électrode où l’oxydation (perte d’électrons) a lieu ; dans une cellule galvanique , c’est l’électrode négative , car lorsque l’oxydation se produit, des électrons sont laissés sur l’électrode. Les ions aqueux positifs de la solution sont réduits par les électrons entrants sur la cathode.
De la même façon, on se demande ce qu’est l’anode dans une pile voltaïque ?
Une pile voltaïque est une cellule électrochimique qui utilise une réaction chimique pour produire de l’énergie électrique. Les parties importantes d’une cellule voltaïque : L’ anode est une électrode où se produit l’oxydation. La cathode est une électrode où se produit la réduction.
L’anode est-elle positive ou négative ?
Dans une pile galvanique (voltaïque), l’ anode est considérée comme négative et la cathode est considérée comme positive . Cependant, la réaction reste similaire : les électrons de l’ anode circulent vers la borne positive de la pile, et les électrons de la pile circulent vers la cathode.
Que voulez-vous dire par anode ?
Une anode est l’électrode d’un dispositif électrique polarisé par laquelle le courant entre depuis un circuit extérieur. Les cathodes tirent leur nom des cations (ions chargés négativement) et les anodes des anions (ions chargés positivement). Dans un dispositif qui consomme de l’électricité, l’ anode est l’électrode positive chargée.
Quel est un exemple de pile voltaïque ?
Exemple de cellule voltaïque
L’électrolyte (le liquide ionique entre les électrodes) est constitué de 20 à 30 % en poids d’hydroxyde de potassium dans l’eau. Le rôle de l’hydroxyde de potassium dans ce cas est d’augmenter la conductivité ionique pour compléter le circuit électrique – l’hydroxyde de potassium n’est pas consommé dans la réaction.
Qu’est-ce que l’anode et la cathode ?
Définition : L’ anode d’un appareil est la borne où le courant entre de l’extérieur. La cathode d’un dispositif est la borne où le courant sort. Par courant, on entend le courant conventionnel positif. Comme les électrons sont chargés négativement, le courant positif qui entre est le même que celui qui sort.
Pourquoi les électrons circulent-ils de l’anode à la cathode ?
Par définition, une cathode est une électrode chargée négativement (une plaque métallique ou un fil), et une anode est une électrode chargée positivement. Par conséquent, les électrons sont repoussés par la cathode et sont attirés par l’ anode , ce qui entraîne un courant de électrons circulant de la cathode à l’ anode .
Qu’est-ce qui affecte la tension d’une cellule voltaïque ?
Le changement d’énergie libre de Gibbs détermine la tension d’une cellule électrochimique . Celle-ci dépend à son tour de facteurs tels que la concentration, la pression du gaz et la température.
Pourquoi le zinc est-il une anode et le cuivre une cathode ?
En circuit fermé, un courant circule entre les deux électrodes. Le zinc se comporte comme la anode (fournissant des électrons) de la cellule galvanique et le cuivre comme la cathode (consommant des électrons).
Pourquoi le courant continu est utilisé dans l’électrolyse ?
Le courant continu ( DC ) est utilisé pour l’électrolyse . Le courant continu permet de déposer les anions dans l’anode et les cations dans la cathode. Si un courant alternatif était utilisé , alors le sens du courant continuera à changer et donc cela conduira à un dépôt inégal d’ions dans les électrodes.
Quel est l’autre nom d’une pile voltaïque ?
Une cellule galvanique ou une cellule voltaïque , nommée respectivement d’après Luigi Galvani ou Alessandro Volta, est une cellule électrochimique .
cellule qui tire de l’énergie électrique des réactions d’oxydoréduction spontanées qui ont lieu au sein de la cellule .
Le zinc est-il une anode ou une cathode ?
Identifiez les réactions d’oxydation et de réduction
Par convention dans la notation standard des cellules, l’ anode est écrite à gauche et la cathode à droite. Donc, dans cette cellule : Zinc est l’ anode (le zinc solide est oxydé). L’argent est la cathode (les ions argent sont réduits).
Où utilise-t-on la cellule de Daniell ?
La cellule de Daniell peut être utilisée pour « produire » de l’électricité, en consommant une électrode, ou pour stocker de l’électricité.
De quoi sont faites la cathode et l’anode ?
Anode et cathode
| Alcaline | Cathode (positive) | Anode (négative) |
|---|---|---|
| Matériau | Dioxyde de manganèse | Zinc |
L’anode est-elle toujours à gauche ?
Les électrons toujours circulent de la anode vers la cathode ou de la demi-cellule d’oxydation vers la demi-cellule de réduction. L’ anode est toujours placée sur le côté gauche , et la cathode est placée sur le côté droit.
Quelle est la différence entre les cellules voltaïques et galvaniques ?
La réaction d’oxydoréduction dans les cellules voltaïques ou galvaniques est spontanée alors que la réaction d’oxydoréduction dans les cellules électrolytiques est induite par une source d’énergie électrique externe. Dans les cellules voltaïques ou galvaniques , l’anode est l’électrode négative et la cathode est l’électrode positive.
Qu’est-ce que la tension de la cellule ?
Définition de la tension cellulaire
« La différence de potentiel électrique entre les deux électrodes d’une cellule électrochimique. La « » tension de cellule « » diffère de la force électromotrice (emf) (ou tension (ocv) en circuit ouvert) de la cellule par la quantité de surtension.
Comment distinguer l’anode de la cathode ?
Différence entre l’anode et la cathode
- La cathode est généralement le côté négatif tandis que l’anode est le côté positif.
- L’anode est l’électrode où l’électricité entre en elle.
- La cathode est l’électrode où l’électricité sort en elle. Ben Joan. Derniers messages de Ben Joan (voir tous)
Que se passe-t-il à la cathode ?
Explication : A la cathode dans une cellule électrolytique, les ions de la solution environnante sont réduits en atomes, qui précipitent ou plaquent sur la cathode solide. L’ anode est l’endroit où l’oxydation a lieu, et la cathode est l’endroit où la réduction a lieu.
La taille de l’électrode affecte-t-elle la tension ?
Dans une cellule idéale, la taille de l’ électrode n’aura pas d’effet sur la tension , puisqu’elle est déterminée par la chimie des électrodes . Si la surface de réaction est le facteur limitant de la vitesse de réaction, le courant augmente proportionnellement à la surface des électrodes .
L'électrolyte (le liquide ionique entre les électrodes) est constitué de 20 à 30 % en poids d'hydroxyde de potassium dans l'eau. Le rôle de l'hydroxyde de potassium dans ce cas est d'augmenter la conductivité ionique pour compléter le circuit électrique - l'hydroxyde de potassium n'est pas consommé dans la réaction." } }, {"@type": "Question","name": " Qu'est-ce que l'anode et la cathode ? ","acceptedAnswer": {"@type": "Answer","text": " Définition : L'anode d'un appareil est la borne où le courant entre de l'extérieur. La cathode d'un dispositif est la borne où le courant sort. Par courant, on entend le courant conventionnel positif. Comme les électrons sont chargés négativement, le courant positif qui entre est le même que celui qui sort." } }, {"@type": "Question","name": " Pourquoi les électrons circulent-ils de l'anode à la cathode ? ","acceptedAnswer": {"@type": "Answer","text": " Par définition, une cathode est une électrode chargée négativement (une plaque métallique ou un fil), et une anode est une électrode chargée positivement. Par conséquent, les électrons sont repoussés par la cathode et sont attirés par l'anode, ce qui entraîne un courant de électrons circulant de la cathode à l'anode." } }, {"@type": "Question","name": " Qu'est-ce qui affecte la tension d'une cellule voltaïque ? ","acceptedAnswer": {"@type": "Answer","text": " Le changement d'énergie libre de Gibbs détermine la tension d'une cellule électrochimique. Celle-ci dépend à son tour de facteurs tels que la concentration, la pression du gaz et la température." } }, {"@type": "Question","name": " Pourquoi le zinc est-il une anode et le cuivre une cathode ? ","acceptedAnswer": {"@type": "Answer","text": " En circuit fermé, un courant circule entre les deux électrodes. Le zinc se comporte comme la anode (fournissant des électrons) de la cellule galvanique et le cuivre comme la cathode (consommant des électrons)." } }, {"@type": "Question","name": " Pourquoi le courant continu est utilisé dans l'électrolyse ? ","acceptedAnswer": {"@type": "Answer","text": " Le courant continu (DC) est utilisé pour l'électrolyse. Le courant continu permet de déposer les anions dans l'anode et les cations dans la cathode. Si un courant alternatif était utilisé, alors le sens du courant continuera à changer et donc cela conduira à un dépôt inégal d'ions dans les électrodes." } }, {"@type": "Question","name": " Quel est l'autre nom d'une pile voltaïque ? ","acceptedAnswer": {"@type": "Answer","text": " Une cellule galvanique ou une cellule voltaïque, nommée respectivement d'après Luigi Galvani ou Alessandro Volta, est une cellule électrochimique." } }, {"@type": "Question","name": " Le zinc est-il une anode ou une cathode ? ","acceptedAnswer": {"@type": "Answer","text": "Identifiez les réactions d'oxydation et de réduction
Par convention dans la notation standard des cellules, l'anode est écrite à gauche et la cathode à droite. Donc, dans cette cellule : Zinc est l'anode (le zinc solide est oxydé). L'argent est la cathode (les ions argent sont réduits)." } }, {"@type": "Question","name": " Où utilise-t-on la cellule de Daniell ? ","acceptedAnswer": {"@type": "Answer","text": " La cellule de Daniell peut être utilisée pour "produire" de l'électricité, en consommant une électrode, ou pour stocker de l'électricité." } }, {"@type": "Question","name": " L'anode est-elle toujours à gauche ? ","acceptedAnswer": {"@type": "Answer","text": " Les électrons toujours circulent de la anode vers la cathode ou de la demi-cellule d'oxydation vers la demi-cellule de réduction. L'anode est toujours placée sur le côté gauche, et la cathode est placée sur le côté droit." } }, {"@type": "Question","name": " Quelle est la différence entre les cellules voltaïques et galvaniques ? ","acceptedAnswer": {"@type": "Answer","text": " La réaction d'oxydoréduction dans les cellules voltaïques ou galvaniques est spontanée alors que la réaction d'oxydoréduction dans les cellules électrolytiques est induite par une source d'énergie électrique externe. Dans les cellules voltaïques ou galvaniques, l'anode est l'électrode négative et la cathode est l'électrode positive." } }, {"@type": "Question","name": " Qu'est-ce que la tension de la cellule ? ","acceptedAnswer": {"@type": "Answer","text": "Définition de la tension cellulaire
"La différence de potentiel électrique entre les deux électrodes d'une cellule électrochimique. La ""tension de cellule"" diffère de la force électromotrice (emf) (ou tension (ocv) en circuit ouvert) de la cellule par la quantité de surtension." } }, {"@type": "Question","name": " Comment distinguer l'anode de la cathode ? ","acceptedAnswer": {"@type": "Answer","text": "Différence entre l'anode et la cathode
La cathode est généralement le côté négatif tandis que l'anode est le côté positif. L'anode est l'électrode où l'électricité entre en elle. La cathode est l'électrode où l'électricité sort en elle. Ben Joan. Derniers messages de Ben Joan (voir tous) " } }, {"@type": "Question","name": " Que se passe-t-il à la cathode ? ","acceptedAnswer": {"@type": "Answer","text": " Explication : A la cathode dans une cellule électrolytique, les ions de la solution environnante sont réduits en atomes, qui précipitent ou plaquent sur la cathode solide. L'anode est l'endroit où l'oxydation a lieu, et la cathode est l'endroit où la réduction a lieu." } }] }