Quelles sont les étapes de la découverte d’un médicament ?
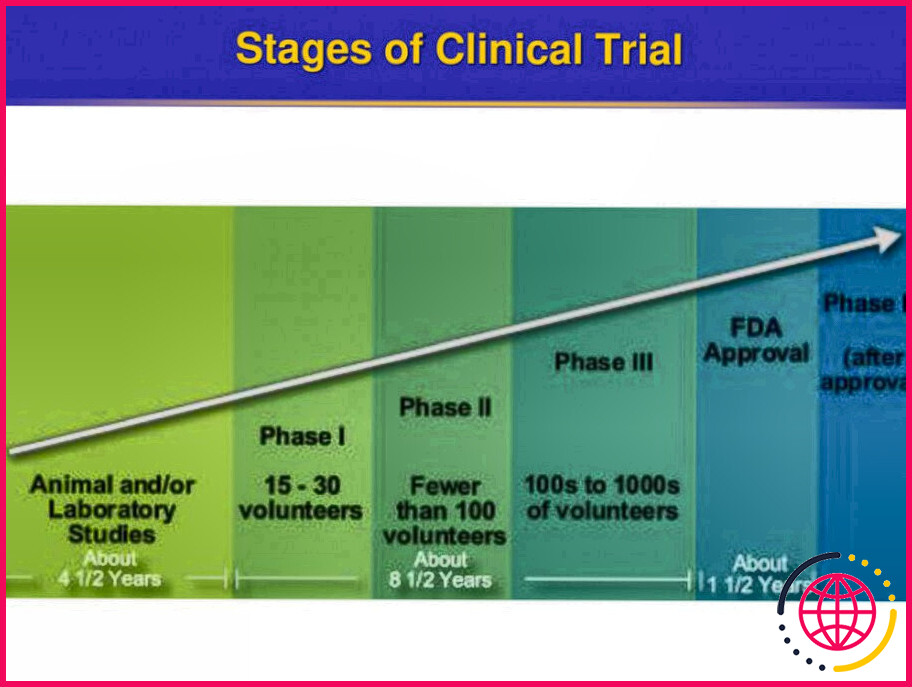
Les essais cliniques phase Cliniques comportent trois ou quatre étapes : Les essais de phase I, généralement chez des volontaires sains, déterminent la sécurité et la posologie. Les essais de phase II servent à obtenir une lecture initiale de l’efficacité et à explorer davantage la sécurité chez un petit nombre de patients atteints de la maladie ciblée par le NCE.
De même, vous pouvez vous demander quelles sont les étapes de la découverte d’un médicament ?
Un aperçu du processus de découverte d’un médicament
- Etape 1 – Identification et validation de la cible. L’identification et la validation de la cible donnent le coup d’envoi de tout le processus de découverte de médicaments.
- Étape 2 – Identification et validation des hits.
- Étape 3 – Passage d’un hit à un lead.
- Étape 4 – Optimisation du lead.
- Étape 5 – Optimisation tardive du lead.
En outre, quelle est la première étape du développement d’un médicament ? Etape 1 : Découverte de médicaments et validation des cibles La première étape du processus de développement de médicaments implique un travail de découverte . C’est là que les entreprises de développement de médicaments choisissent une molécule, telle qu’un gène ou une protéine, à cibler avec un médicament .
De même, on se demande quelles sont les quatre phases du développement d’un médicament ?
Phases du développement de médicaments
- Phase 1 : Découverte et développement.
- Phase 2 : Recherche préclinique.
- Phase 3 : Recherche clinique.
- Phase 4 : Examen par la FDA.
- Phase 5 : Surveillance de la sécurité post-commercialisation par la FDA.
Combien de temps faut-il pour que les médicaments soient approuvés ?
Aux États-Unis, il faut en moyenne 12 ans pour qu’un médicament expérimental passe du laboratoire à votre armoire à pharmacie. C’est-à-dire, s’il réussit . Seuls 5 sur 5 000 médicaments qui entrent dans les tests précliniques passent aux tests sur l’homme. L’un de ces 5 médicaments qui sont testés chez l’homme est approuvé .
Comment les nouveaux médicaments sont-ils développés ?
Le processus de développement de médicaments . La recherche d’un nouveau médicament commence en laboratoire. Les médicaments subissent des tests en laboratoire et sur les animaux pour répondre aux questions de base sur la sécurité. Les médicaments sont testés sur des personnes pour s’assurer qu’ils sont sûrs et efficaces.
Combien de temps faut-il pour développer un nouveau médicament ?
En moyenne, il demande au moins dix ans pour qu’un nouveau médicament effectue le trajet entre la découverte initiale et le marché, les essais cliniques seuls prenant six à sept ans en moyenne. Le coût moyen de la recherche et du développement de chaque médicament réussi est estimé à 2,6 milliards de dollars.
Quelle est la différence entre la découverte et le développement de médicaments ?
Dans les domaines de la médecine, de la biotechnologie et de la pharmacologie, la découverte de médicaments est le processus par lequel de nouveaux candidats médicaments sont découverts. Une fois qu’un composé qui remplit toutes les de ces exigences a été identifié, le processus de développement de médicaments peut se poursuivre et, en cas de succès, des essais cliniques sont développés.
Qui a découvert le premier médicament ?
Premiers Composés synthétiques En 1832, l’hydrate de chloral était le premier composé synthétique créé par le chimiste allemand Justus von Liebig. Cependant, cette substance n’a pas été utilisée médicalement comme sédatif-hypnotique avant 1869. Le composé est encore utilisé par les prestataires de soins de santé dans certains pays aujourd’hui.
Comment les médicaments sont-ils approuvés ?
Aux États-Unis, la FDA approuve les médicaments . Les entreprises de médicaments qui cherchent à vendre un médicament aux États-Unis doivent d’abord le tester. L’entreprise envoie ensuite au Center for Drug Evaluation and Research (CDER) de la Food and Drug Administration des preuves issues de ces tests pour prouver que le médicament est sûr et efficace pour l’usage prévu.
Qu’est-ce qu’un médicament exactement ?
Un médicament est tout produit chimique que vous prenez et qui affecte la façon dont votre corps fonctionne. L’alcool, la caféine, l’aspirine et la nicotine sont tous des médicaments . Une médicament doit pouvoir passer de votre corps à votre cerveau. Une fois dans votre cerveau, les médicaments peuvent modifier les messages que vos cellules cérébrales s’envoient entre elles et au reste de votre corps.
Qu’est-ce qu’une étude de phase 4 ?
Un type d’essai clinique qui étudie les effets secondaires causés au fil du temps par un nouveau traitement après qu’il ait été approuvé et qu’il soit sur le marché. Les essais cliniques de phase IV peuvent inclure des milliers de personnes. Également appelé essai clinique de phase 4 et essai de surveillance post-commercialisation.
Qu’est-ce qu’une étude de phase 1 ?
Essai de phase 1 Intervenant . La première étape de l’essai d’un médicament expérimental (ou d’un autre traitement) chez l’homme. Phase 1
Les essais évaluent la sécurité et la toxicité du médicament à différents niveaux de dose et déterminent la pharmacocinétique du médicament.
Quelle est la différence entre la phase 2a et 2b ?
Les études de phase 2 sont généralement menées sur un nombre limité de sites. Ces études sont parfois divisées en essais Phase 2A et Phase 2B , où les essais Phase 2A sont spécifiquement conçus pour évaluer la posologie, et Phase 2B est spécifiquement conçu pour déterminer l’efficacité.
Que fait un CRO ?
Un organisme de recherche sous contrat ( CRO ) est une entreprise qui fournit un soutien aux industries pharmaceutiques, biotechnologiques et des dispositifs médicaux sous la forme de services de recherche externalisés sur une base contractuelle. Les CRO sont conçus pour réduire les coûts des entreprises qui développent de nouveaux médicaments et des médicaments dans des marchés de niche.
Qu’est-ce que le cycle de développement des médicaments ?
Le développement d’un nouveau produit thérapeutique (c’est-à-dire un nouveau médicament ou produit biologique) est un processus long, complexe et coûteux qui prend généralement de 10 à 12 ans (et parfois plus) de l’identification du produit à sa commercialisation.
Qu’est-ce que le CMC médicament ?
CMC – Chimie, fabrication et contrôles. Ces activités sont connues sous le nom de CMC , chimie, fabrication et contrôle. Toutes les étapes du cycle de vie du médicament , après la découverte du médicament impliquent la CMC . Au cours du développement préclinique du médicament , les méthodes analytiques appropriées sont validées pour contrôler le produit.
Combien de phases y a-t-il dans un essai de médicament ?
Les essais cliniques impliquant de nouveaux médicaments sont communément classés en quatre phases . Les essais individuels peuvent englober plus d’une phase . Un exemple courant est celui des phases I/II ou phases II/III trials combinés.
Quel est le processus de développement des produits pharmaceutiques ?
Les médecins pharmaceutiques sont impliqués dans chaque étape du processus de développement des médicaments . La médecine translationnelle est le processus qui consiste à faire passer une nouvelle idée thérapeutique du laboratoire à la clinique. Les essais de phase 0 sont les premiers essais sur l’homme. Des doses subthérapeutiques du médicament à l’étude sont administrées pour recueillir des données préliminaires.
Comment conçoit-on un médicament ?
Au sens le plus élémentaire, la conception de médicaments consiste à concevoir des molécules dont la forme et la charge sont complémentaires de la cible biomoléculaire avec laquelle elles interagissent et qui vont donc s’y fixer. La conception de médicaments s’appuie fréquemment mais pas nécessairement sur des techniques de modélisation informatique.