Qu’est-ce qu’un spectre d’émission atomique ?
Les spectres d émission atomique sont des spectres uniques de la lumière émise par un élément lorsqu on le fait passer à l électricité ou qu on le regarde à travers un prisme. Parce qu ils sont uniques, ils peuvent agir comme l empreinte digitale d un élément. C’est un ensemble de fréquences du spectre électromagnétique émis par les éléments excités d’un atome .
De même, on peut se demander ce qu’est le spectre d’émission atomique en chimie ?
Les spectres d’émission atomique sont des spectres uniques de la lumière émise par un élément lorsque l’électricité le traverse ou lorsqu’il est vu à travers un prisme. Parce qu ils sont uniques, ils peuvent agir comme l empreinte digitale d un élément. C est un ensemble de fréquences du spectre électromagnétique émis par les éléments excités d un atome .
En outre, comment un spectre d émission atomique est-il produit ? Donc, les spectres d’émission sont produits par des gaz minces dans lesquels les atomes ne subissent pas beaucoup de collisions (à cause de la faible densité). Les raies d’ émission correspondent à des photons d’énergies discrètes qui sont émis lorsque des états atomiques excités dans le gaz effectuent des transitions pour revenir à des niveaux inférieurs.
Dans ce cas, à quoi sert un spectre d’émission atomique ?
La spectroscopie d’émission atomique peut être utilisée pour déterminer l’identité, la structure et l’environnement des atomes en analysant le rayonnement émis par ceux-ci.
Qu’est-ce qu’un spectre d’émission atomique quizlet ?
Spectres d’émission atomique . Les spectres discontinus de lumière produits lorsque des atomes excités retournent à leur état fondamental et émettent des photons d’une certaine fréquence. Spectre d’absorption atomique. Le spectre de certaines longueurs d’onde de lumière absorbées correspondant au spectre d’un atome de fréquences de lumière émises .
Comment se forment les spectres ?
Un spectre d’émission est le motif de raies formé lorsqu’un élément est excité et dégage de l’énergie. Un spectre d’absorption se forme lorsque la lumière blanche traverse un gaz froid. Le gaz absorbe certaines longueurs d’onde d’énergie et en laisse passer d’autres.
Comment pouvez-vous utiliser le spectre d’émission d’un élément pour l’identifier ?
Chaque élément naturel possède un spectre lumineux caractéristique qui permet de l’ identifier dans des échantillons de substances inconnues. La spectroscopie est la pratique consistant à examiner les spectres et à les comparer à ceux des éléments connus. Grâce aux méthodes de spectroscopie, les scientifiques peuvent identifier des substances ou des composés purs et les éléments qu’ils contiennent.
Qu’est-ce que l’émission signifie ?
Techniquement, une émission est tout ce qui a été libéré à l’air libre. Mais le plus souvent, il s’agit de gaz libérés dans l’air, comme les gaz à effet de serre ou les émissions des centrales électriques et des usines. Chaque fois que votre corps émet quelque chose (sueur, bave, gaz), c’est également considéré comme une émission .
Comment fonctionnent les spectres d’émission ?
Comment un spectre d’émission est produit . Lorsqu’un atome ou une molécule absorbe de l’énergie, les électrons sont propulsés dans un état d’énergie plus élevé. Lorsque l’électron tombe dans un état d’énergie inférieur, un photon est libéré, égal à l’énergie entre les deux états.
Pourquoi le spectre d’émission est-il important ?
Les spectres d’émission sont importants pour les scientifiques pour deux raisons. Premièrement, parce que le spectre d’émission d’un élément est caractéristique de cet élément, les scientifiques peuvent souvent utiliser les spectres d’émission pour déterminer quels éléments sont présents ou absents dans un échantillon inconnu.
Quelle est la couleur qui a le plus d’énergie ?
Quelle est la couleur du spectre de la lumière visible la plus énergétique. La couleur qui a le plus d’énergie est le violet . Comme les ondes violettes ont la longueur d’onde la plus courte, elles transportent le plus d’énergie.
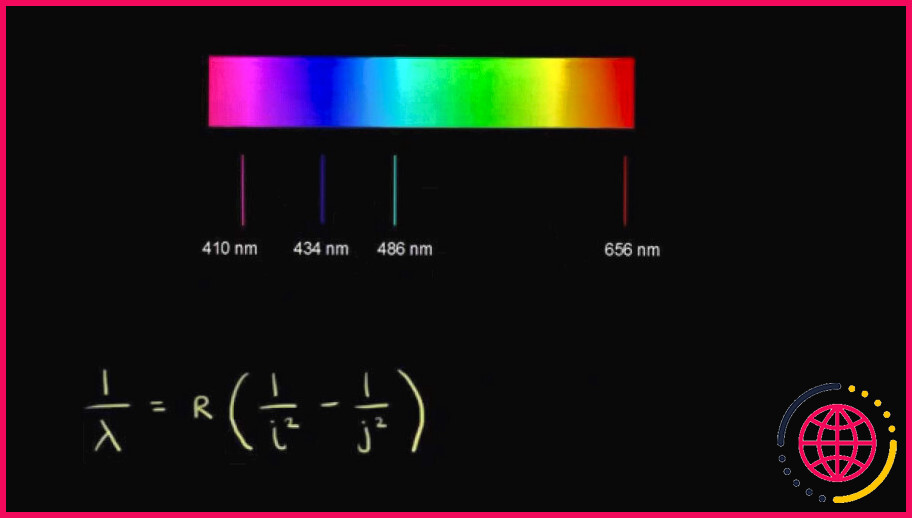
Quelle est la longueur d’onde du spectre de l’hydrogène ?
Spectre d’émission de l’hydrogène
| Longueur d’onde | Couleur |
|---|---|
| 656,2 | rouge |
| 486,1 | bleu-vert |
| 434,0 | bleu-violet |
| 410,1 | violet |
D’où proviennent les raies d’émission ?
Une ligne d’émission apparaîtra dans un spectre si la source émet des longueurs d’onde spécifiques de rayonnement. Cette émission se produit lorsqu’un atome, un élément ou une molécule dans un état excité revient à une configuration de plus faible énergie.
Comment bénéficie-t-on des spectres d’émission dans le monde réel ?
Une des utilisations de cette technique est d’identifier les éléments présents dans les étoiles lointaines. Ainsi, les éléments peuvent être identifiés par les couleurs que leurs atomes produisent lorsque l’énergie (par chauffage ou courant électrique) est utilisée pour révéler leurs emissions empreintes digitales.
Qu’est-ce qu’un spectre de corps noir ?
Un corps noir est un corps théorique ou modèle qui absorbe tous les rayonnements qui tombent sur lui, n’en réfléchissant ni n’en transmettant aucun. La distribution spectrale de l’énergie thermique rayonnée par un corps noir (c’est-à-dire la configuration de l’intensité du rayonnement sur une gamme de longueurs d’onde ou de fréquences) ne dépend que de sa température.
Comment la lumière est-elle produite ?
La lumière est constituée de petits paquets d’énergie appelés photons. La plupart de ces photons sont produits lorsque les atomes d’un objet chauffent. La chaleur « excite » les électrons à l’intérieur des atomes et ils gagnent de l’énergie supplémentaire. Cette énergie supplémentaire est ensuite libérée sous forme de photon.
Quelle est la différence entre un spectre continu et un spectre d’émission atomique ?
Le spectre continu de la lumière blanche ne traite que des fréquences et des longueurs d’onde des couleurs associées à l’arc-en-ciel. Le spectre d’émission atomique traite des couleurs, des fréquences et des longueurs d’onde qui sont libérées par un atome particulier.
Pourquoi différents éléments produisent-ils différentes couleurs ?
Lorsque vous chauffez un atome, certains de ses électrons sont « excités* à des niveaux d’énergie plus élevés. Lorsqu’un électron passe d’un niveau à un niveau d’énergie inférieur, il émet un quantum d’énergie. Le différent mélange de différences d’énergie pour chaque atome produit différentes couleurs . Chaque métal donne un spectre d’émission de flamme caractéristique.
Pourquoi ces niveaux d’énergie signifient-ils que l’atome va présenter un spectre d’émission ?
Lorsque cette émission se produit, elle se produit sous forme de lumière. Par conséquent, les spectres d’émission atomiques représentent les électrons d’un atome retournant vers des niveaux d’énergie inférieurs. Chaque élément a un arrangement caractéristique des orbitales électroniques et des énergies qui dicte la couleur des lignes d’ émission sera .
Pourquoi chaque élément a-t-il un spectre d’émission atomique distinct ?
Le spectre d’émission de chaque élément est distinct parce que chaque élément possède un ensemble différent de niveaux d’énergie électroniques. Les raies (photons) sont émises lorsque les électrons tombent des orbitales d’énergie supérieure vers les énergies inférieures. Voici un diagramme des transitions émission de l’hydrogène.
À quoi peuvent servir les spectres d’émission atomique et pourquoi cela est-il possible ?
Lorsqu’un atome absorbe de l’énergie, ses électrons sautent vers des niveaux d’énergie plus élevés. Chaque transition a une différence d’énergie spécifique. Cette collection de transitions constitue un spectre d’émission . Ces spectres d’émission sont aussi distinctifs pour chaque élément que les empreintes digitales le sont pour les personnes.
Comment se forment les raies d’absorption ?
L’intensité dépend de la densité et de la température du gaz. Une raie d’ absorption est produite lorsqu’un photon ayant juste la bonne énergie est absorbé par un atome, bottant un électron vers une orbite d’énergie supérieure. D’autres photons se déplaçant à travers le gaz avec la mauvaise énergie passeront juste à côté des atomes dans le gaz mince.