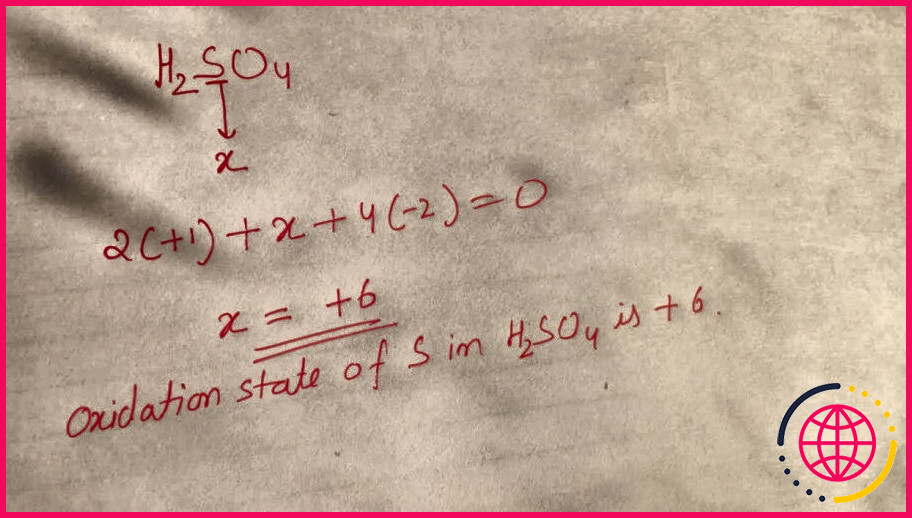Qu’est-ce qu’une notation de stock ?
Notations de stock : La méthode de représentation du nombre d’oxydation d’un métal par les chiffres romains I, II, III etc. à l’intérieur des paranthèses est connue sous le nom de notation de stock .
À cet égard, quel est l’exemple de la notation de stock ?
Le nombre d’oxydation de Fe2O3 est 3.En appliquant la méthode de notation de stock , nous pouvons représenter le nombre d’oxydation du composé mentionné ci-dessus dans le composé lui-même comme Fe2(III)O3. La méthode de la notation de stock aide à représenter le nombre d’oxydation du métal en utilisant le chiffre romain.
Deuxièmement, à quoi servent les nombres d’oxydation ? Les nombres d’oxydation sont utilisés par les chimistes pour garder la trace des électrons dans un composé. On peut utiliser des lignes directrices pour attribuer des nombres d’oxydation aux atomes d’un composé. Les changements d’état d’ oxidation au cours d’une réaction nous indiquent qu’il y a un transfert d’électrons.
De même, on peut se demander comment on obtient le nombre d’oxydation ?
Explication :
- Le nombre d’oxydation d’un élément libre est toujours 0.
- Le nombre d’oxydation d’un ion monatomique est égal à la charge de l’ion.
- Le nombre d’oxydation de H est +1, mais il est -1 dans lorsqu’il est combiné avec des éléments moins électronégatifs.
- Le nombre d’oxydation de O dans les composés est généralement -2, mais il est -1 dans les peroxydes.
Quelle est l’utilité de la notation de stock ?
La notation de stock est utilisée est utilisée pour nommer les composés qui résultent de la variation des valences de certains éléments.
Qu’est-ce qu’un couple redox ?
Un agent oxydant et un agent réducteur qui apparaissent sur les côtés opposés d’une demi-équation constituent un couple redox . Les couples redox sont analogues aux paires acide-base conjuguées et se comportent à peu près de la même façon. Si une ligne est tracée de l’agent oxydant à l’agent réducteur pour une telle réaction, elle aura une pente descendante.
Quel est l’état d’oxydation de l’oxygène dans le peroxyde ?
-1
Que sont les réactions de disproportionnement ?
La dismutation est une réaction chimique, typiquement une réaction d’oxydoréduction, où une molécule est transformée en deux ou plusieurs produits dissemblables. Dans une réaction redox , l’espèce est simultanément oxydée et réduite pour former au moins deux produits différents. Les réactions de Disproportionnement suivent la forme : 2A → A’ + A »
Quelle est la notation boursière de CuO ?
Cu2+ est réduit à l’état Cu(I).
Réactions d’oxydoréduction.
| Formule du composé | O.N. de l’élément métallique | Notation de stock |
|---|---|---|
| CuI | 1 | Cu(I)I |
| CuO | 2 | Cu(II)O |
| MnO | 2 | Mn(II)O |
| MnO2 | 4 | Mn(IV)O2 |
Qu’est-ce que le système de stock en chimie ?
: un système en nomenclature et notation chimique consistant à indiquer l’état d’oxydation de l’élément significatif dans un composé ou un ion par moyen d’un chiffre romain qui est utilisé entre parenthèses après le nom ou la partie du nom désignant cet élément et se terminant invariablement par -ate dans le cas d’un anion et qui est placé
Que sont les réactions d’oxydo-réduction ?
Une oxidation – réduction ( redox ) réaction est un type de réaction chimique qui implique un transfert d’électrons entre deux espèces. Une réaction d’ oxydation – réduction est toute réaction chimique dans laquelle le nombre d’ oxydation d’une molécule, d’un atome ou d’un ion change en gagnant ou en perdant un électron.
Quelles sont les règles pour nommer les composés ?
Lorsque l’on nomme des composés moléculaires, on utilise des préfixes pour dicter le nombre d’un élément donné présent dans le composé . » Mono- » indique un, » di- » indique deux, » tri- » est trois, » tétra- » est quatre, » penta- » est cinq, et » hexa- » est six, » hepta- » est sept, » octo- » est huit, » nona- » est neuf, et » déca » est dix.
Qu’est-ce qu’un composé moléculaire ?
Un composé moléculaire peut être défini comme un composé où les atomes partagent des électrons par des liaisons covalentes. Il est également connu comme un composé covalent . Les liaisons covalentes sont ce qui maintient la molécule ensemble. Lorsque les atomes partagent des électrons, ils sont capables d’avoir une coquille électronique externe complète.
Qu’est-ce qu’un nom de système boursier ? La nomenclature
Stock pour les composés inorganiques est un système de nomenclature chimique largement utilisé, développé par le chimiste allemand Alfred Stock et publié pour la première fois en 1919. Dans le » Système Stock
‘, les états d’oxydation de certains ou de tous les éléments d’un composé sont indiqués entre parenthèses par des chiffres romains.
Que voulez-vous dire par valence ?
En chimie, la valence ou valence d’un élément est une mesure de son pouvoir de combinaison avec d’autres atomes lorsqu’il forme des composés chimiques ou des molécules. Le concept de valence a été développé dans la seconde moitié du 19ème siècle et a contribué à expliquer avec succès la structure moléculaire des composés inorganiques et organiques.
Qu’est-ce qu’un bon agent oxydant ?
Cela signifie qu’ils attirent facilement les électrons. Comme vous pouvez le voir dans le tableau périodique des éléments, les halogènes qui sont de bons agents oxydants sont le fluor, le chlore, le brome et l’iode, le fluor étant l’agent oxydant le plus fort parmi les quatre, suivi du chlore, du brome et de l’iode.
Que signifie u par état d’oxydation ?
Définition de l’état d’oxydation : un nombre positif ou négatif qui représente la charge effective d’un atome ou d’un élément et qui indique l’étendue ou la possibilité de son oxydation l’état d’oxydation habituel du sodium est +1 et celui de l’oxygène -2.
Quel est le nombre d’oxydation de N ?
Les composés azotés , quant à eux, englobent des états d’oxydation de l’azote allant de -3, comme dans l’ammoniac et les amines, à +5, comme dans l’acide nitrique. Le tableau suivant énumère certains des composés organiques connus de l’ azote , présentant différents états d’oxydation de cet élément.
Quel est le nombre d’oxydation du Fe ?
+2
Comment savez-vous si c’est une oxydation ou une réduction ?
Identifier les éléments oxydés et réduits
- Attribuer des nombres d’oxydation à tous les atomes de l’équation.
- Comparer les nombres d’oxydation du côté du réactif au côté du produit de l’équation.
- L’élément oxydé est celui dont le nombre d’oxydation a augmenté.
- L’élément réduit est celui dont le nombre d’oxydation a diminué.
Quels sont les éléments libres ?
Élément libre. En chimie, un élément libre est un élément chimique qui n’est pas combiné ou lié chimiquement à d’autres éléments. Des exemples d’éléments qui peuvent se présenter comme des éléments libres comprennent la molécule oxygène (O2) et le carbone. Tous les atomes des éléments libres ont un nombre d’oxydation de 0.
Quel est le nombre d’oxydation de tous les éléments ?
Calcul des états d’oxydation
| élément | état d’oxydation habituel | exceptions |
|---|---|---|
| Métaux du groupe 1 | toujours +1 | (voir note ci-dessous) |
| Métaux du groupe 2 | toujours +2 | |
| Oxygène | habituellement -2 | sauf dans les peroxydes et F2O (voir ci-dessous) |
| Hydrogène | habituellement +1 | sauf dans les hydrures métalliques où il est -1 (voir ci-dessous) |
.