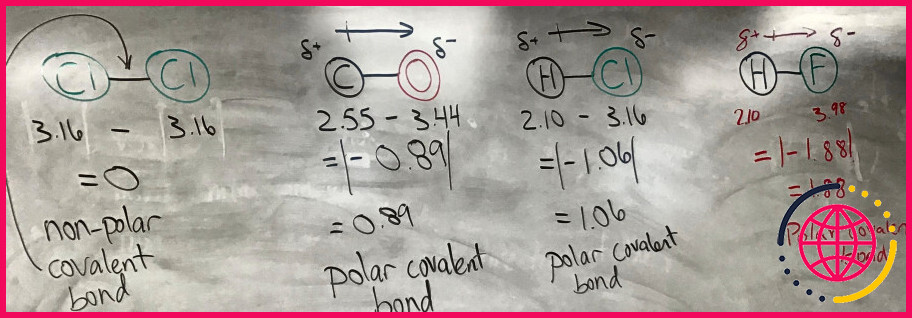Quand trouver la différence d’électronégativité ?
La différence d’électronégativité est la mesure de la force avec laquelle le noyau d’un atome attire les électrons vers lui-même. Plus la différence d’électronégativité est élevée, plus le noyau d’un atome éloignera les électrons des autres atomes.
La différence d’électronégativité est utilisée pour prédire de nombreuses propriétés chimiques, telles que la force des liaisons entre les atomes. Plus la différence d’électronégativité est grande, plus la liaison sera forte. En général, des liaisons ioniques se forment entre des atomes présentant de grandes différences d’électronégativité, tandis que des liaisons covalentes se forment entre des atomes présentant de petites différences d’électronégativité.
La différence d’électronégativité peut également être utilisée pour prédire d’autres propriétés chimiques. Par exemple, il peut être utilisé pour prédire avec quelle facilité un atome perdra ou gagnera des électrons. Les atomes avec de grandes différences d’électronégativité ont tendance à perdre des électrons plus facilement que les atomes avec de petites différences d’électronégativité. En effet, plus la différence d’électronégativité est grande, plus le noyau d’un atome est attractif pour les électrons. En conséquence, les atomes avec de grandes différences d’électronégativité ont tendance à être plus réactifs que les atomes avec de petites différences d’électronégativité.
Lorsque deux atomes sont liés entre eux, la différence entre leurs électronégativités peut vous renseigner sur les qualités de leur liaison. Soustrayez la plus petite électronégativité de la plus grande pour trouver la différence.
Pourquoi avons-nous besoin de comprendre la différence d’électronégativité ?
Aucune différence d’électronégativité entre deux atomes conduit à une liaison covalente pure non polaire. Une petite différence d’électronégativité conduit à une liaison covalente polaire. Une grande différence d’électronégativité conduit à une liaison ionique.
Quelle est la règle de l’électronégativité ?
La règle est que lorsque la différence d’électronégativité est supérieure à 2,0, la liaison est considérée comme ionique. Alors, passons en revue les règles : 1. Si la différence d’électronégativité (généralement appelée ΔEN) est inférieure à 0,5, alors la liaison est covalente non polaire.
Lorsque la différence d’électronégativité entre deux atomes augmente, qu’arrive-t-il à la force du dipôle de la liaison ?
Moment du dipôle de liaison
L’atome à plus grande électronégativité aura plus d’attraction pour les électrons liés que l’atome à plus petite électronégativité ; plus la différence entre les deux électronégativités est grande, plus le dipôle est grand.
Les liaisons ioniques sont-elles plus électronégatives ?
La différence d’électronégativité ΔEN entre les atomes d’une liaison ionique doit être supérieure à 1,6. Les liaisons n’ont pas d’électronégativité. Les différences entre les électronégativités des atomes déterminent le caractère ionique de la liaison. Les liaisons vont de 100 % covalentes à 100 % ioniques, avec toutes les valeurs intermédiaires.
L’électronégativité augmente-t-elle le moment dipolaire ?
Les moments dipolaires se produisent lorsqu’il y a une séparation de charge. Ils peuvent se produire entre deux ions dans une liaison ionique ou entre des atomes dans un bon covalent.d; Les moments dipolaires proviennent de différences d’électronégativité. Plus la différence d’électronégativité est grande, plus le moment dipolaire est grand.
Lequel des phénomènes suivants augmente lorsque la différence d’électronégativité entre 2 atomes augmente ?
2 : Lorsque la différence d’électronégativité augmente entre deux atomes, la liaison devient plus ionique. La figure 6.1 présente une approximation grossière des différences d’électronégativité associées aux liaisons covalentes, covalentes polaires et ioniques.
Comment peut-on trouver l’électronégativité ?
Sur le tableau périodique, l’électronégativité augmente généralement lorsque vous vous déplacez de gauche à droite sur une période et diminue lorsque vous descendez dans un groupe. Par conséquent, les éléments les plus électronégatifs se trouvent en haut à droite du tableau périodique, tandis que les éléments les moins électronégatifs se trouvent en bas à gauche.
Comment trouver la différence d’électronégativité entre trois éléments ?
Soustraire l’électronégativité la plus petite de la plus grande pour trouver la différence. Par exemple, si on regarde la molécule HF, on soustrait l’électronégativité de l’hydrogène (2,1) à celle du fluor (4,0). 4.0 – 2.1 = 1.9. Si la différence est inférieure à environ 0,5, la liaison est covalente non polaire.
Quels sont les facteurs qui influent sur l’électronégativité ?
L’électronégativité d’un atome est affectée à la fois par son numéro atomique et par la taille de l’atome. Plus son électronégativité est élevée, plus un élément attire les électrons. L’opposé de l’électronégativité est l’électropositivité, qui est une mesure de la capacité d’un élément à donner des électrons.
Quel est l’exemple d’électronégativité ?
Exemple d’électronégativité
L’atome de chlore a une électronégativité plus élevée que l’atome d’hydrogène, donc les électrons de liaison seront plus proches du Cl que du H dans la molécule de HCl. Les électrons de la liaison covalente sont partagés équitablement entre les deux atomes d’oxygène.
Quelle est la valeur d’électronégativité la plus élevée ?
L’échelle d’électronégativité a été développée par le chimiste américain Linus Pauling, lauréat du prix Nobel. La plus grande électronégativité (3,98) est attribuée au fluor et toutes les autres mesures d’électronégativités sont sur une échelle relative.
Quelle est l’importance de l’électronégativité ?
Parce que les atomes n’existent pas de manière isolée et forment plutôt des composés moléculaires en se combinant avec d’autres atomes, le concept d’électronégativité est important car il détermine la nature des liaisons entre les atomes.
Lequel est le plus électronégatif : N ou O ?
1. L’électronégativité est une mesure de la tendance d’un atome à attirer une paire d’électrons de liaison. Mais l’oxygène a 8 protons dans le noyau alors que l’azote n’en a que 7. Une paire de liaison subira plus d’attraction de la part du noyau de l’oxygène que de celui de l’azote, et donc l’électronégativité de l’oxygène est plus grande.
Quels sont les quatre éléments les plus électronégatifs ?
Dans cette échelle, le néon a la plus grande électronégativité de tous les éléments, suivi du fluor, de l’hélium et de l’oxygène.
Lequel de ces trois éléments est le plus électronégatif Pourquoi ?
Trois éléments X, Y et Z ont respectivement les numéros atomiques 7, 8 et 9. (b) Z est le plus électronégatif car il n’a besoin que d’un seul électron pour atteindre la configuration stable.
Comment le moment dipolaire augmente-t-il ?
Un dipôle existe lorsqu’il y a des zones de charges positives et négatives asymétriques dans une molécule. Les moments dipolaires augmentent avec le caractère de la liaison ionique et diminuent avec le caractère de la liaison covalente.
Le moment dipolaire est-il directement proportionnel à l’électronégativité ?
Explication : Les dipôles sont créés lorsqu’un élément a une électronégativité (tendance à attirer les électrons) plus élevée qu’un autre dans une liaison. Le moment dipolaire est la mesure globale de la force dipolaire des dipôles dans une molécule, et plus la différence d’électronégativité est élevée, plus le moment dipolaire est grand.
Comment calcule-t-on le moment dipolaire ?
Le moment dipolaire est le produit de la magnitude de la charge et de la distance entre les centres des charges positives et négatives. Il est désigné par la lettre grecque « µ ». Il est mesuré en unités Debye désignées par ‘D’. 1 D = 3.33564 × 10–30 C.m, où C est Coulomb et m désigne un mètre.
Une différence d’électronégativité plus importante signifie-t-elle une liaison plus forte ?
En général, oui. Une plus grande différence d’électronégativité indique que la liaison est plus ionique. Comme les liaisons ioniques sont connues pour avoir des caractéristiques de liaison fortes, il est logique que plus une liaison est ionique, plus la liaison est forte.
HF est-il une liaison covalente ou ionique ?
Le fluorure d’hydrogène. C’est un gaz à liaison covalente à température ambiante. La différence d’électronégativité entre l’hydrogène et le fluorure place la liaison dans une zone grise que certaines sources classeront comme ionique. La liaison H-F (différence d’électronégativité 1,78) est considérée comme covalente polaire car l’hydrogène est non métallique.
Qu’est-ce qu’une liaison ionique en termes d’électronégativité ?
La liaison ionique a lieu lorsque la différence d’électronégativité entre les deux atomes est supérieure à 1,7. Cela se produit généralement lorsqu’un atome métallique se lie à un atome non métallique. Lorsque des liaisons ioniques se forment, un métal donne un ou plusieurs électrons, du fait de sa faible électronégativité, pour former un ion positif ou un cation.