Comment fabrique-t-on des esters en laboratoire ?
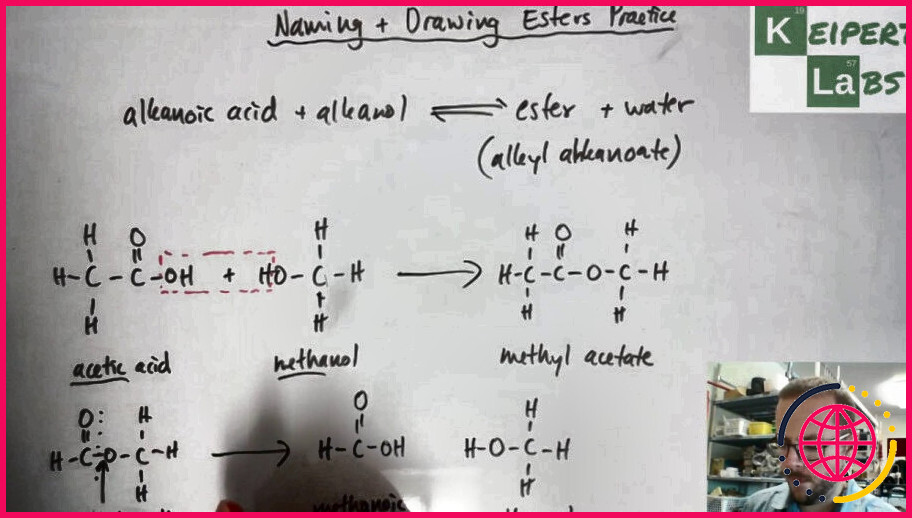
Les esters existent à l’état naturel – souvent sous forme de graisses et d’huiles – mais ils peuvent être fabriqués au laboratoire en faisant réagir un alcool avec un acide organique . Un peu d’acide sulfurique est nécessaire comme catalyseur . Ainsi, pour fabriquer de l’éthanoate d’éthyle, il faudrait faire réagir de l’éthanol avec de l’acide éthanoïque.
Alors, comment prépare-t-on un ester en laboratoire ?
Vous pouvez synthétiser un ester en laboratoire en chauffant un acide carboxylique dans une solution d’alcool contenant une petite quantité d’acide fort comme catalyseur. L’acide que vous utiliserez dans cette expérience est l’acide salicylique, dont la structure est présentée ci-dessous.
De même, quels sont les produits chimiques nécessaires pour préparer un ester au laboratoire ?
Les esters d’acide carboxylique, de formule RCOOR′ (R et R′ sont des groupes organiques combinés quelconques), sont communément préparés par réaction d’acides carboxyliques et d’alcools en présence d’acide chlorhydrique ou d’acide sulfurique, un processus appelé estérification.
En gardant cela à l’esprit, comment les esters sont-ils fabriqués dans l’industrie ?
Les esters sont produits lorsque des acides carboxyliques sont chauffés avec des alcools en présence d’un catalyseur acide. Le catalyseur est généralement de l’acide sulfurique concentré. Le chlorure d’hydrogène gazeux sec est utilisé dans certains cas, mais ceux-ci ont tendance à impliquer des esters aromatiques (ceux où l’acide carboxylique contient un cycle benzénique).
Comment synthétise-t-on les esters ?
Les esters sont obtenus par reflux de l’acide carboxylique parent avec l’alcool approprié avec un catalyseur acide. L’équilibre peut être conduit à son terme en utilisant un excès soit de l’alcool, soit de l’acide carboxylique, ou en éliminant l’eau au fur et à mesure de sa formation.
Pourquoi ajoute-t-on de l’eau à un ester avant de le sentir ?
Juste une supposition en fait – l’ ester n’est pas soluble dans l’ eau et donc lorsque vous ajoutez le mélange à l’ eau , il flotterait sur le dessus de l’ eau – ce qui rendrait plus facile l’ sentiment par rapport à l’alcool et à l’acide carboxylique – qui se dissolvent dans l’ eau .
Quel est le but de l’estérification ?
Dans cette leçon, nous avons appris qu’une réaction d’ estérification consiste à prendre un acide carboxylique et un alcool et à les faire réagir ensemble en présence d’un catalyseur acide, généralement de l’acide sulfurique, pour obtenir un ester . Plaque d’agitation : le but d’une plaque d’agitation est de favoriser une ébullition douce et régulière du mélange réactionnel.
Pourquoi les esters ont-ils une odeur ?
Les esters sentent en partie parce qu’ils présentent de faibles forces intermoléculaires. Cela permet aux molécules d’ ester de passer en phase gazeuse et d’atteindre votre nez. Les esters ne présentent pas de liaison hydrogène intermoléculaire, contrairement aux alcools, par exemple.
Comment tester les esters ?
Une façon simple de détecter l’odeur de l’ ester est de verser le mélange dans un peu d’eau dans un petit bécher. A part les très petits, les esters sont assez insolubles dans l’eau et ont tendance à former une fine couche à la surface. L’acide et l’alcool en excès se dissolvent tous deux et sont rangés en toute sécurité sous la couche d’ esters .
Les esters sont-ils inflammables ?
Plusieurs esters sont inflammables ou hautement inflammables . Les esters de faible poids moléculaire comme le formiate de méthyle ont des points d’éclair bas et des limites d’ inflammabilité larges, ce qui en fait des dangers d’ inflammabilité . Les esters carboxyliques réagissent avec les acides pour libérer de la chaleur en même temps que les alcools et les acides.
Pourquoi les esters sont-ils insolubles dans l’eau ?
Les esters peuvent former des liaisons hydrogène par leurs atomes d’oxygène aux atomes d’hydrogène des molécules d’ eau . Ainsi, les esters sont légèrement solubles dans l’ eau . Cependant, comme les esters ne possèdent pas d’atome d’hydrogène pour former une liaison hydrogène avec un atome d’oxygène de l’ eau , ils sont moins solubles que les acides carboxyliques.
Comment l’alcool n’ayant pas réagi sera-t-il éliminé du mélange réactionnel final il sera séparé du produit ester ?
A la suite d’études sur la séparation des esters à partir du mélange réactionnel , on a maintenant découvert que le ester peut être facilement séparé en faisant réagir un alcool avec une quantité excessive d’acide organique basée sur celle de l’ alcool , et éliminer l’alcool n’ayant pas réagi du mélange réactionnel sous forme d’un azéotrope alcool – ester .
Qu’est-ce que la formule Ester ?
Les esters ont la formule générale.
RCOOR′, où R peut être un atome d’hydrogène, un groupe alkyle, ou un groupe aryle, et R′ peut être un groupe alkyle ou un groupe aryle mais pas un atome d’hydrogène. (Si c’était un atome d’hydrogène, le composé serait un acide carboxylique.) Les esters montrés ici sont l’acétate d’éthyle (a) et le butyrate de méthyle (b).
Quels sont les exemples d’esters ?
Exemples d’esters
L’hydrogène sur le groupe carboxyle de l’acide acétique est remplacé par un groupe éthyle. D’autres exemples d’esters comprennent le propanoate d’éthyle, le méthanoate de propyle, l’éthanoate de propyle et le butanoate de méthyle.
Pourquoi les esters ne sont-ils pas utilisés dans les parfums ?
Les esters ont souvent un arôme fruité agréable comme on peut le voir dans le tableau à droite. Cependant, cela ne pas les rend nécessairement idéaux pour les perfums . La plupart des esters simples dégagent ces odeurs agréables, mais les problèmes surviennent parce qu’ils ne sont pas préparés à gérer la sueur que dégage un corps humain.
Les esters sont-ils acides ou basiques ?
Les esters sont des composés neutres, contrairement aux acides à partir desquels ils sont formés. Dans les réactions typiques, le groupe alcoxy (OR′) d’un ester est remplacé par un autre groupe. Une de ces réactions est l’hydrolyse, littéralement « scission avec de l’eau ». L’hydrolyse des esters est catalysée soit par un acide, soit par une base .
Quelles sont les propriétés des esters ?
Propriétés physiques et caractérisation
Les esters sont plus polaires que les éthers mais moins polaires que les alcools. Ils participent aux liaisons hydrogène en tant qu’accepteurs de liaison hydrogène , mais ne peuvent pas agir en tant que donneurs de liaison hydrogène , contrairement à leurs alcools parents. Cette capacité à participer à la liaison hydrogène leur confère une certaine solubilité dans l’eau.
Le COOH est-il un acide ou une base ?
Les groupes carboxyles sont des acides faibles, se dissociant partiellement pour libérer des ions hydrogène. Le groupe carboxyle (symbolisé par COOH ) a à la fois un groupe carbonyle et un groupe hydroxyle attachés au même atome de carbone, ce qui entraîne de nouvelles propriétés.
Qu’est-ce que la valeur ester ?
La valeur ester est le nombre de mg d’hydroxyde de potassium nécessaire pour saponifier les esters dans 1,0 g de la substance.
Pourquoi les esters sont-ils de bons solvants ?
La raison pour laquelle les esters peuvent être de bons solvants est cependant qu’ils sont capables de dissoudre des liquides organiques. Ceux qui sont des solvants ont généralement moins de 6 carbones et sont des bons solvants en raison de leur nature polaire.
Pourquoi les esters sont-ils importants dans l’industrie ?
Les acides carboxyliques sont également importants dans la fabrication des graisses, des crayons et des plastiques. Ces esters sont considérés comme des dérivés des acides carboxyliques. Esters sont importants car beaucoup d’entre eux ont des goûts et des odeurs caractéristiques. Par exemple, le butyrate de méthyle, un dérivé de l’acide butyrique, sent la pomme.
Comment nomme-t-on les esters ?
Les esters sont nommés comme si la chaîne alkyle de l’alcool était un substituant. Ceci est suivi du nom de la chaîne parentale de la partie acide carboxylique de l’ ester avec un -e enlevé et remplacé par la terminaison -oate.