La cystéine peut-elle être déprotonée ?
Oui, la cystéine peut être déprotonée. En effet, la cystéine a une valeur de pKa relativement élevée (environ 8,5). Cela signifie qu’il peut perdre un proton (H+) à des valeurs de pH supérieures à 8,5. Au pH physiologique (7,4), la cystéine est majoritairement sous forme déprotonée (Cys-).
chaque cation métallique peut induire la déprotonation de la cystéine, comment le milieu diélectrique affecte ce processus, et dans quelle mesure les autres ligands de la première et de la deuxième coquille de coordination du métal influencent l’ionisation de la cystéine.
La cystéine peut-elle être déprotonée dans des conditions basiques ?
Les thiols ont un pK(a) généralement autour de 9-10. Ainsi, à pH neutre ou acide, ils sont neutres (le soufre est protoné). Mais dans des conditions basiques, à un pH supérieur à leurs valeurs de pK(a), l’atome de soufre est déprotoné formant un anion thiol. Donc le pH commence à affecter le statut du groupe SH de la cystéine aux valeurs supérieures à 8-8,5.
Comment la cystéine est-elle dégradée ?
Chimie redox des thiols biologiques
Dans la voie de la cystéine dioxygénase (CDO) du métabolisme de la cystéine, la CDO oxyde la cystéine libre en acide cystéine sulfinique, qui se décompose finalement en taurine ou en pyruvate et en sulfate [168].
A quel pH la cystéine est-elle déprotonée ?
Le comportement a été étudié à des pH de 5,21 (à ce pH, la L-cystéine est une espèce zwitterionique), 1,00 (espèce protonée), 8,84 (espèce monodéprotonée) et 13,00 (espèce didéprotonée).
La cystéine est-elle protonée à pH 7 ?
Les valeurs de pKa pour les groupes acide α-carboxylique et acide α-aminé est la cystéine sont respectivement de 1,092 et 10,78. La structure de la cystéine à pH = 7 montre que le groupe latéral est protoné. Nous devons donc conclure que même si le pKa est de 8,33, le sulfhydryle (-SH) agit comme un acide.
La cystéine peut-elle former des liaisons hydrogène ?
Les interactions de liaison hydrogène de la cystéine, qui peut servir de donneur et/ou d’accepteur de liaison hydrogène, jouent un rôle central dans les divers rôles fonctionnels de la cystéine dans les protéines.
La cystéine peut-elle être réduite ?
Le groupe sulfhydryle de la cystéine peut être considéré également comme un facteur réducteur très fort, qui est très important pour l’activité de nombreuses protéines, d’un oligopeptide (glutathion), a une forte influence sur le potentiel redox de l’environnement dans certains compartiments in vivo, et peut former un centre du site actif de certaines enzymes (…).
Quelle est la différence entre la cystéine et la cystine ?
Réponse : La cystéine est un acide aminé contenant du soufre que l’on trouve dans des aliments comme la volaille, les œufs, les produits laitiers, les poivrons rouges, l’ail et les oignons. La cystine, qui est formée de deux molécules de cystéine jointes ensemble, est plus stable que la cystéine, mais peut ne pas être aussi bien absorbée. Cet acide aminé est également un composant des cheveux, de la peau et des ongles.
Pourquoi la cystéine est-elle instable dans l’air ?
Acides aminés, peptides et protéines
La cystéine est un acide aminé contenant du soufre. Elle est instable dans l’air. En raison du fait que la cystéine a tendance à être absorbée dans les cellules où elle ne peut pas présenter sa propriété antioxydante, la N-acétyl-cystéine (NAC) est souvent utilisée à la place à cette fin.
Quels sont les effets secondaires de la cystéine ?
La N-acétyl cystéine est un médicament sur ordonnance approuvé par la FDA. Il peut provoquer des effets secondaires tels que la sécheresse de la bouche, des nausées, des vomissements et des diarrhées.
Quels sont les aliments riches en cystéine ?
Les pois chiches, le couscous, les œufs, les lentilles, l’avoine, la dinde et les noix sont de bonnes sources pour obtenir de la cystéine à travers votre alimentation. En dehors des protéines, les légumes allium sont l’une des principales sources de soufre alimentaire.
Quelle protéine est riche en cystéine ?
Une protéine riche en cystéine est la kératine.
A quoi sert la L glycine ?
La glycine est utilisée pour traiter la schizophrénie, les accidents vasculaires cérébraux, l’hyperplasie bénigne de la prostate (HBP) et certains troubles métaboliques héréditaires rares. Elle est également utilisée pour protéger les reins des effets secondaires nocifs de certains médicaments utilisés après une transplantation d’organe ainsi que le foie des effets nocifs de l’alcool.
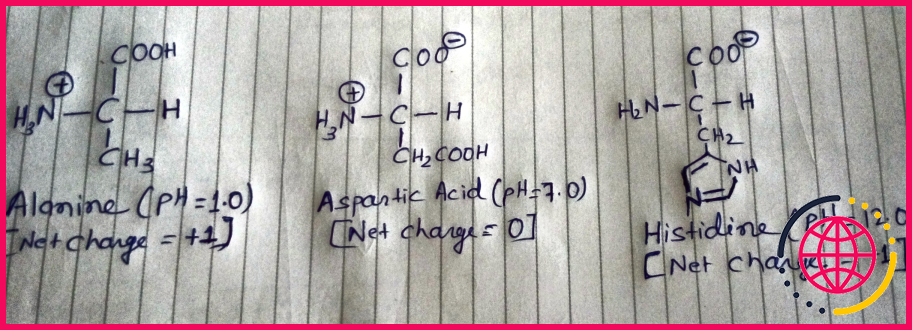
Comment savoir si un acide aminé est positif ou négatif ?
Parmi les 20 acides aminés courants, cinq ont une chaîne latérale qui peut être chargée. A pH=7, deux sont chargés négativement : l’acide aspartique (Asp, D) et l’acide glutamique (Glu, E) (chaînes latérales acides), et trois sont chargés positivement : la lysine (Lys, K), l’arginine (Arg, R) et l’histidine (His, H) (chaînes latérales basiques).
La cystéine est-elle mauvaise pour les cheveux ?
La cystéine, qui est un acide aminé, est utilisée dans le traitement pour renforcer vos cheveux et les rendre raides. Le traitement protégera également vos cheveux des dommages, diminuera les frisottis et ajoutera de la brillance. Vos cheveux seront faciles à entretenir après le traitement. La cystéine est considérée comme sûre car elle n’utilise pas de formaldéhyde.
Quelle est la particularité de la cystéine ?
La cystéine est un acide aminé unique car sa chaîne latérale contient un groupe thiol libre qui peut réagir avec un autre thiol (généralement d’un autre résidu de cystéine) pour former un lien disulfure. S’ils sont correctement formés, les liens disulfure peuvent stabiliser les protéines et favoriser leur stabilité.
Quels sont les avantages de la cystéine ?
La cystéine peut jouer un rôle dans le taux de croissance normal des cheveux. La cystéine peut également contribuer à réduire les effets du vieillissement sur la peau. Elle peut aider à la cicatrisation après une chirurgie ou des brûlures et protéger la peau des lésions dues aux radiations. La cystéine peut aider à brûler les graisses et à augmenter la masse musculaire.
La cystéine peut-elle être absorbée par la peau ?
Les suppléments de cystéine sont parfois commercialisés comme des produits anti-âge avec des allégations d’amélioration de l’élasticité de la peau. La cystéine est plus facilement absorbée par le corps que la cystine, de sorte que la plupart des suppléments contiennent de la cystéine plutôt que de la cystine.
Qu’arrive-t-il à la cystéine en présence d’oxygène ?
La cystéine est spontanément oxydée en cystine à pH neutre.1,2; à pH acide. En présence d’oxygène, cette conversion par radiation de la cystéine en cystine est très rapide, et une valeur G de 74 a été rapportée8, bien que le taux exact de conversion dépende de la concentration de cystéine et de la tension d’oxygène9.
Comment prendre la L-cystéine ?
La NAC peut être administrée par voie intraveineuse ou prise par voie orale, sous forme de spray aérosol ou sous forme de liquide ou de poudre. Résumé La consommation d’aliments riches en protéines peut fournir à votre corps l’acide aminé cystéine, mais la NAC peut également être prise sous forme de supplément pour aider à traiter certaines conditions.
Quels types de liaisons la cystéine peut-elle former ?
La cystéine est le seul acide aminé dont la chaîne latérale peut former des liaisons covalentes, donnant des ponts disulfures avec d’autres chaînes latérales de cystéine : –CH2-S-S-CH2–. Ici, la cystéine 201 du peptide modèle est vue comme étant liée de manière covalente à la cystéine 136 d’un β-brin adjacent.
Le soufre et l’hydrogène peuvent-ils se lier ?
Les atomes de soufre sont connus pour participer à des liaisons hydrogène (liaisons H) et ces liaisons H contenant du soufre (SCHB) sont suggérées pour jouer des rôles importants dans certains processus biologiques. Il est révélé que l’atome de soufre est un très mauvais accepteur de liaisons H, mais un donneur de liaisons H modérément bon.
Quels sont les acides aminés dont les chaînes latérales peuvent former des liaisons hydrogène ?
Les acides aminés asparagine et glutamine possèdent des groupes amides dans leurs chaînes latérales qui sont généralement liés à l’hydrogène chaque fois qu’ils apparaissent à l’intérieur d’une protéine.