Le phénol donne-t-il la réaction de friedel craft ?
3 Réponses. Comme l’aniline, le phénol réagit également dans une très faible mesure au cours de la réaction de Friedel – Crafts . La raison étant que l’atome d’oxygène du phénol possède une paire d’électrons solitaires qui se coordonnent avec l’acide de Lewis. sur le cycle aromatique donnant une arylcétone via la C- acylation , une Friedel – Réaction de Crafts .
Considérant ceci, le phénol subit-il une alkylation de Friedel Crafts ? Il est préférable d’utiliser des réactifs qui peuvent générer l’électrophile sans utiliser d’acides de Lewis. L’acylation de Friedel — Crafts sur les phénols nécessite des conditions plus sévères, par exemple une température élevée. Le phénol devient un complexe avec AlCl3 et par conséquent son activité est diminuée.
Deuxièmement, comment le phénol réagit-il à l’acylation ? Ch24 – Acylation des phénols . Les phénols sont des exemples de nucléophiles bidentés, ce qui signifie qu’ils peuvent réagir à deux positions : sur le cycle aromatique en donnant une arylcétone par C- acylation , une réaction de Friedel-Crafts ou, sur l’oxygène phénolique en donnant un ester par O- acylation , une estérification.
De cette manière, lequel ne donne pas de réaction de Friedel Craft ?
L’acide benzoïque ne donne pas de réaction de Friedel Craft pourquoi.
Le chlorobenzène donne-t-il la réaction de Friedel Craft ?
Oui, la réaction va se dérouler par Friedel – alkylation de Crafts : Tout d’abord, le catalyseur acide de Lewis abstrait l’ion chlorure du chlorure de méthyle, donnant un ion méthénium réactif et électrophile. Ensuite, les électrons du système π du cycle benzène du chlorobenzène attaquent alors l’ion électrophile.
Le phénol est-il un acide de Lewis ?
Le phénol est un acide très faible et la position d’équilibre se situe bien à gauche. Le Phénol peut perdre un ion hydrogène car l’ion phénoxyde formé est stabilisé dans une certaine mesure. La charge négative de l’atome d’oxygène est délocalisée autour du cycle. Plus l’ion est stable, plus il a de chances de se former.
Pourquoi l’AlCl3 anhydre ne convient-il pas pour réaliser l’alkylation du phénol ?
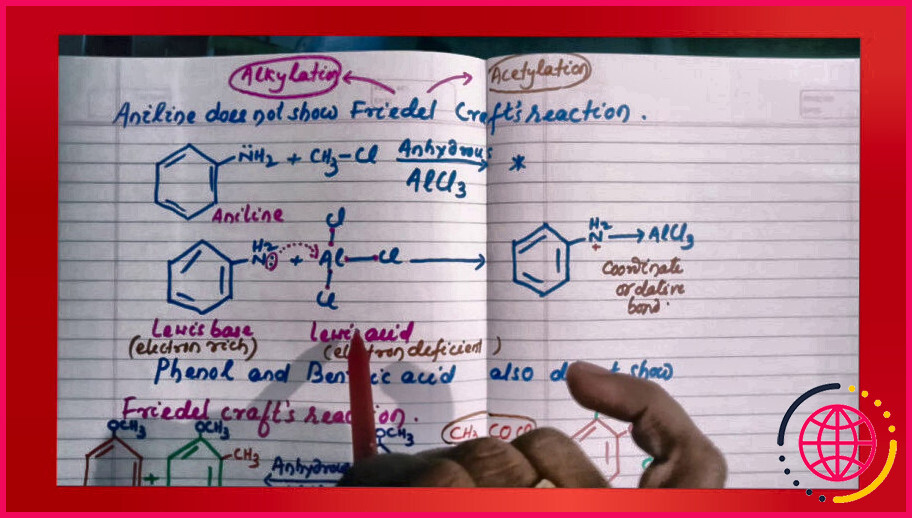
Le but principal de l’utilisation de AlCl3 est de polariser la liaison halo alcane( alkylation ). Le groupe OH agit comme une base de Lewis et se lie avec AlCl3 au lieu de l’haloalcane et donc entrave le processus de alkylation …. De même, l’aniline ne présentera pas non plus de réarrangement de friedel alkylation .
Qu’est-ce que la réaction de réarrangement de Fries ?
Le réarrangement de Fries , du nom du chimiste allemand Karl Theophil Fries , est une réaction de réarrangement d’un ester phénolique en une hydroxy aryl cétone par catalyse des acides de Lewis.
L’aniline peut-elle subir une réaction de Friedel ?
L’aniline ne pas subir les réactions de Friedel craft car le réactif AlCl3 (l’acide de Lewis qui est utilisé comme catalyseur dans la réaction de friedel crafts ), étant déficient en électrons agit comme une base de Lewis.
Lequel subira la réaction d’alkylation de Friedel Crafts ?
Une réaction d’alkylation de Friedel – Crafts est une réaction de substitution aromatique électrophile dans laquelle un carbocation attaque un cycle aromatique avec le résultat net qu’un des protons aromatiques est remplacé par un groupe alkyle. les halogénures de vinyle et d’aryle ne peuvent pas être utilisés pour former des carbocations.
Pourquoi l’anisole est-il moins réactif que le phénol ?
Dans le anisole , la stabilisation du résonace provenant de la paire d’électrons solitaires sur l’atome d’oxygène est quelque peu perturbée par une hyperconjugaison. Cet effet est cependant absent dans le phénol et donc le cycle aromatique est plus riche en électrons, ainsi le phénol est plus réactif que l’anisole vis-à-vis de la substitution aromatique électrophile.
Que se passe-t-il lorsque le phénol est traité par le ch3cocl ?
Explication : Lorsque le phénol est mis en réaction avec le chlorure d’acétyle en présence d’hydroxyde de sodium, cela conduit à la formation d’esters phényliques et cette réaction conduira à la formation d’éthanoate de phényle. Cette réaction montre la nature acide du phénol . La réaction correspondante est donnée dans l’image ci-jointe.
Qu’est-ce que l’acylation en chimie organique ?
L’acylation est une réaction de chimie organique utilisée pour ajouter un groupe acyle à un composé. La réaction d’ acylation la plus courante est une acylation de Friedel-Crafts, du nom des scientifiques qui l’ont découverte. Le mécanisme qui conduit cette réaction est une substitution aromatique électrophile.
Quand peut-on ne pas faire de Friedel-Crafts ?
Les réactions de Friedel – Crafts ne se produisent pas lorsque de puissants groupes attracteurs d’électrons sont présents sur le cycle aromatique ou lorsque le cycle porte un groupe -NH2, -NHR, ou -NR2. Cela s’applique aux alkylations et aux acylations.
Quelles sont les limites de la réaction d’alkylation de Friedel Craft ?
Résumé des limites des alkylations de Friedel-Crafts :
- L’halogénure doit être soit un halogénure d’alkyle.
- Les réactions d’alkylation sont sujettes à des réarrangements de carbocation.
- Les benzènes désactivés ne sont pas réactifs aux conditions de Friedel-Crafts, le benzène doit être aussi ou plus réactif qu’un mono-halobenzène (voir effets des substituants)
.
Pourquoi le nitrobenzène ne donne-t-il pas de réactions de Friedel-Craft ?
Le nitrobenzène ne subit pas d’alkylation de Friedel – Craft car le groupe nitro est un groupe attracteur d’électrons très fort, ce qui rend le système aromatique auquel il est attaché très pauvre en électrons. Le nitrobenzène est utilisé comme solvant en laboratoire et dans l’industrie, notamment pour les réactifs électrophiles.
Le benzaldéhyde subit-il la réaction de Friedel ?
L’acide benzaldéhyde subit-il la réaction de crafts de Friedel ? Non, il ne le fait pas car le doublet solitaire sur l’oxygène va former une liaison avec AlCl3( qui est un acide de Lewis) et former un sel.
Qu’est-ce que la suralkylation ?
Les réactions d’alkylation sont sujettes à des réarrangements de carbocation. La suralkylation peut être un problème car le produit est plus réactif que le produit de départ. Ceci peut généralement être contrôlé avec un excès de benzène. Le catalyseur acide de Lewis AlCl3 se complexe souvent aux arylamines, ce qui les rend très peu réactives.
Quels sont les avantages de l’acylation de Friedel Crafts par rapport à l’alkylation de Friedel Crafts ?
Avantages de l’acylation de Friedel – Crafts . L’acylation de Friedel – Crafts présente quelques avantages par rapport à l’alkylation de Friedel – Crafts et utilise un catalyseur acide de Lewis et un chlorure d’acyle pour ajouter un groupe acyle au benzène. Les cétones produites peuvent être réduites en groupes alkyle en utilisant la réduction de Clemmensen.
Pourquoi la polysubstitution se produit-elle fréquemment avec l’alkylation de Friedel Crafts mais pas avec l’acylation de Friedel Crafts ?
Réponse d’expert. La polysubstitution se produit fréquemment avec l’alkylation de Friedel – Crafts mais pas avec l’acylation de Friedel – Crafts . Ceci s’explique. Alkylation de Friedel – Crafts – C’est la alkylation du noyau benzénique avec un halogénure d’alkyle en présence d’un acide de Lewis tel que AlCl3 ou FeCl3.
Qu’est-ce que la réaction d’acétylation ?
L’acétylation est une réaction chimique qui est appelée éthanoylation dans la nomenclature IUPAC. Elle décrit une réaction qui introduit un groupe fonctionnel acétyle dans un composé chimique. La réaction chimique inverse est appelée désacétylation – il s’agit de l’élimination du groupe acétyle.
Que signifie l’acylation ?
En chimie, l’ acylation (ou alcanoylation) est le processus d’ajout d’un groupe acyle à un composé. Le composé fournissant le groupe acyle est appelé l’agent acylant . L’ Acylation peut être utilisée pour prévenir les réactions de réarrangement qui se produiraient normalement lors de l’alkylation.