Pourquoi le nabh4 est-il ajouté lentement ?
Ajouté lentement parce que la quantité de chaleur libérée par NaBH4 devait être contrôlée. Les fumées libérées sont un signe que la réaction est présente. NaBH4 a réagi avec l’hydrogène acide et l’eau a généré du gaz d’hydrogène. L’acide acétique glacial est utilisé un co-solvant pour abaisser le pH de la réaction pour augmenter la vitesse de la réaction.
Correspondant, pourquoi NaBH4 est moins réactif que LiAlH4?
NaBH4 est moins réactif que LiAlH4 mais est autrement similaire. Il est seulement assez puissant pour réduire les aldéhydes, les cétones et les chlorures d’acide en alcools : les esters, les amides, les acides et les nitriles sont largement intacts. Il peut également se comporter comme un nucléophile envers les halogénures et les époxydes.
Deuxièmement, que réduit le NaBH4 ?
NaBH4 réduit les aldéhydes, les cétones et les chlorures d’acide en alcools. Il ne peut pas réduire les acides, les esters et les amides. NaBH4 se décompose en cation Na et en anion BH4.
En conséquence, pourquoi faut-il maintenir le ballon de réaction froid pendant l’ajout de borohydrure de sodium ?
Dans le cas du borohydrure de sodium , l’eau glacée froide est nécessaire car le NaBH4 réagit violemment et rapidement avec l’eau à température ambiante. L’eau très froide ralentit suffisamment cette réaction pour permettre la réduction de vos ions argent.
Le NaBH4 peut-il réduire le C N ?
Le borohydrure de sodium , et même les versions modifiées où certains des ligands hydrure sont remplacés par d’autres comme N aBH3 CN , peuvent réduire les imines. Vous pouvez donc en principe obtenir principalement 1 avec un borohydrure de sodium limité, ou 4 si vous avez suffisamment de borohydrure de sodium pour attaquer à la fois les fonctions carboxyle et imine moins réactives.
Pourquoi NaBH4 ne peut pas réduire les acides carboxyliques ?
Les acides carboxyliques et les esters sont beaucoup moins réactifs à la réduction que les cétones et les aldéhydes et le borohydrure de sodium , NaBH4 (aq) est un agent réducteur trop faible pour eux. A ce stade, la réactivité est trop faible pour se produire sans un réducteur plus fort.
Le LiAlH4 est-il un nucléophile ?
Comme beaucoup d’autres bases fortes, l’ion hydrure dans LiAlH4 est un bon nucléophile , et LiAlH4 contient son propre acide de Lewis « intégré », l’ion lithium.
Pourquoi LiAlH4 ne peut pas réduire les alcènes ?
Pourquoi l’hydrure de lithium et d’aluminium ne peut pas réduire les alcènes ? Ceux-ci ne peuvent pas attaquer une double liaison carbone-carbone riche en électrons, ni être attaqués par une paire d’électrons négatifs d’une orbitale pi.
Que peut réduire LiAlH4 ?
* C’est un agent réducteur nucléophile, mieux utilisé pour réduire les liaisons multiples polaires comme C=O. * LiAlH4 peut réduire les aldéhydes en alcools primaires, les cétones en alcools secondaires, les acides carboxyliques et les esters en alcools primaires, les amides et les nitriles en amines, les époxydes en alcools et les lactones en diols.
Est-ce qu’un autre agent réducteur peut remplacer NaBH4 ?
Une alternative plus active au borohydrure de sodium dans la réduction des composés carbonylés est l’hydrure de lithium aluminium. Le borohydrure de sodium réagit lentement avec les esters mais l’hydrure de lithium et d’aluminium réagit avec eux rapidement et produit des alcools par réduction de l’ester en l’aldéhyde et réduction de l’aldéhyde .
Pourquoi NaBH4 ne peut pas réduire les halogénures primaires ?
AlLiH4 est normalement utilisé pour réduire 1° alkyl halogénure , la raison étant que pendant le processus de la réaction, Al développe une charge négative. Dans le NaBH4 , la charge négative est développée par le non métal, B, qui est relativement stable. Cela ralentit la réaction faisant de l’hydrure un nucléophile plus faible.
Le LiAlH4 est-il un agent réducteur fort ?
L’hydrure de lithium et d’aluminium ( LiAlH4 ) est un fort agent réducteur . Il va réduire presque tout groupe fonctionnel contenant C=O en un alcool. Un équivalent de H- s’ajoute, puis un autre équivalent s’ajoute, inévitablement.
Pourquoi LiAlH4 ne peut être utilisé dans un solvant protique ?
Comme H (2.10) est plus électronégatif que Al (1.61), H porte une charge négative importante et LiAlH4 réagit violemment avec des solvants protiques comme H2O et ROH pour former du H2 inflammable.
On doit donc utiliser des solvants inertes/ anhydres/ non protiques comme R2O et THF.
Quel est le but d’un bain de glace en chimie ?
Un bain de refroidissement , en chimie de laboratoire.
pratique, est un mélange liquide qui est utilisé pour maintenir les basses températures, généralement entre 13 °C et -196 °C.
Pourquoi utilise-t-on un excès de borohydrure de sodium ?
Question : 1) Expliquez pourquoi un Excès significatif de borohydrure de sodium , NaBH4 est utilisé pour réduire les composés aldéhydiques contenant des groupes fonctionnels acides supplémentaires (par exemple, les phénols, les acides carboxyliques). Donnez une réaction chimique équilibrée pour une mole d’un acide carboxylique (R-COOH) réagissant avec une mole de NaBH4 .
Que fait NaBH4 dans une réaction ?
Borohydrure de sodium. Le borohydrure de sodium ( NaBH4 ) est un réactif qui transforme les aldéhydes et les cétones en alcool correspondant, primaire ou secondaire, respectivement.
Avec lequel des solvants ci-dessous l’hydrure de lithium et d’aluminium ne réagira pas ?
L’hydrure d’aluminium et le borohydrure réagissent tous deux avec les solvants protiques tels que l’eau et l’éthanol. Par conséquent, l’hydrure de lithium aluminium ne peut être utilisé que dans des solvants aprotiques tels que l’éther diéthylique. L’anion borohydrure est beaucoup moins réactif que l’ hydrure d’aluminium . Il réagit seulement lentement avec les solvants protiques comme l’eau.
Que se passe-t-il lorsque le borohydrure de sodium réagit avec l’eau ?
A des niveaux de pH inférieurs, le borohydrure de sodium réagit de manière exothermique avec l’ eau pour générer de l’hydrogène gazeux inflammable. La chaleur peut enflammer l’hydrogène, le solvant et les matériaux combustibles environnants [Haz. Le BOROHYDRIDE DE SODIUM est un puissant agent réducteur. Une base chimique.
Pourquoi était-il nécessaire de titrer la solution froide dans le bain de glace mais pas de titrer la solution chaude dans le bain chaud ?
Il était nécessaire de titrer la solution froide dans le bain de glace car les températures plus basses provoqueraient une titration plus lente et la solution aurait le temps de se réchauffer augmentant significativement la solubilité du Ca(OH) 2 .
Comment le borohydrure de sodium en excès est-il décomposé ?
Mise au point du mélange réactionnel Une fois la réaction terminée, le borohydrure de sodium en excès est décomposé en acidifiant le mélange réactionnel à pH 6 ou moins (lentement et en agitant) en utilisant du HCl dilué (~ 6 M).
Quel groupe fonctionnel est réduit dans le processus de réduction du Benzil et quel est l’agent réducteur ?
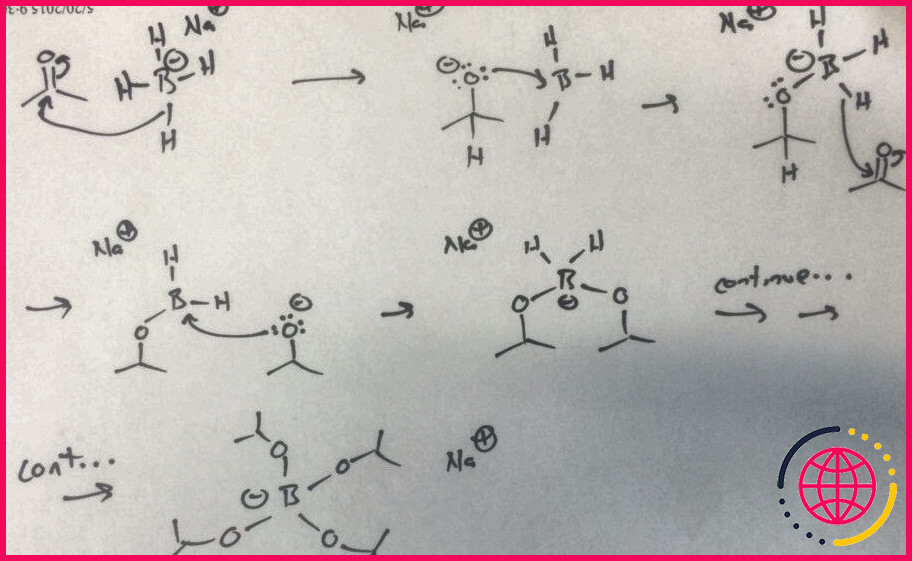
Dans ce laboratoire, l’agent réducteur , le borohydrure de sodium, est utilisé pour réduire le benzil en hydrobenzoine. Le mécanisme montre que l’hydrure chargé négativement sur l’espèce BH4– attaque le carbone carbonyle pour finalement former un complexe où l’atome de bore est chélaté à 4 molécules de carbonyle réduites en même temps.
Le Dibal H réduit-il les acides carboxyliques ?
La réponse est oui, il réduit les deux. Non seulement eux, il réduit également les nitriles en aldéhydes , et est un réactif plus sélectif que l’hydrure de lithium et d’aluminium (LAH) dans la réduction des nitriles (Réf. 1) a constaté que DIBAL – H peut être utilisé pour réduire l’acide benzoïque pour donner des rendements de 72% d’alcool benzylique en 1959.