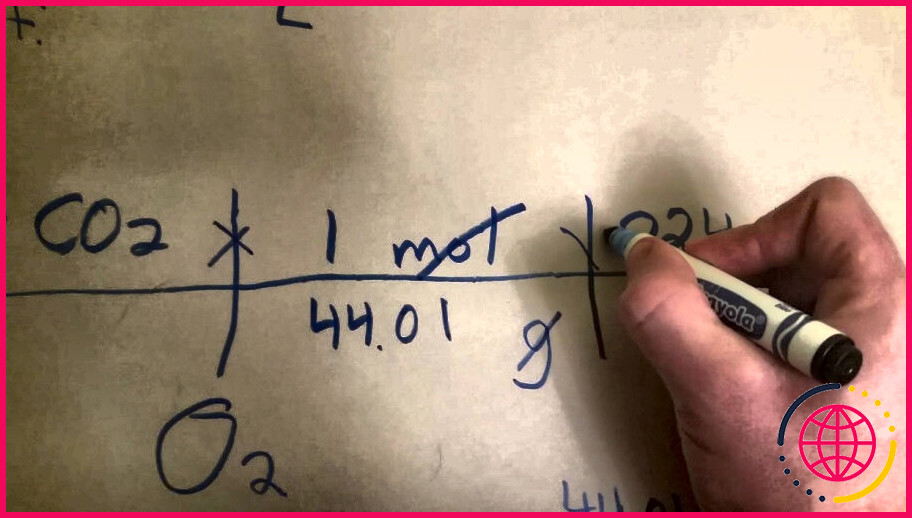Quel est le volume molaire de dioxyde de carbone ?
Le le volume d’une mole de CO2 produit est de 24 dm^3 à température et pression ambiantes. Alternativement, si votre réaction a eu lieu à température et pression standard (273 K, 1 atm), alors le volume molaire est de 22,4 dm^3.
Simplement, quel est le volume molaire du carbone ?
Volume molaire des éléments
| Hydrogène | 0,01121 | Thallium |
|---|---|---|
| Carbone | 5.3146×10–6 | Radon |
| Azote | 0,011197 | francium |
| Oxygène | 0,011196 | Radium |
| Fluor | 0,011202 | Actinium |
On peut aussi se demander, comment trouve-t-on le volume molaire d’un gaz ?
Il peut être calculé en divisant Molaire masse (M) par masse volumique (ρ). Une taupe de n’importe quel gaz à une température et une pression particulières a fixé le volume et connu comme son Volume de gaz molaire . Où Vm est le le volume de la substance. 1 mole de gaz à STP = 22,4 litres de gaz .
De même, on peut se demander quel est le volume molaire de dioxyde de carbone à STP ?
22,4 L
A quoi sert le volume molaire ?
L’unité SI de volume molaire est en mètres cubes par mole (m3/mol). Cependant, parce que c’est un si grand le volume les autres unités sont généralement utilisé . Centimètres cubes par mole (cm3/mol) est utilisé pour solides et liquides. Décimètres cubes par mole (dm3/mol) peut être utilisé pour des gaz.
Pourquoi le volume molaire est-il important ?
C’est une quantité utile pour « penser » les choses d’un point de vue moléculaire. Comme tous les gaz qui se comportent idéalement ont la même densité numérique, ils auront tous le même volume molaire . Au STP, ce sera 22,4 L. Ceci est utile si vous souhaitez visualiser la distance entre les molécules dans différents échantillons.
Qu’est-ce que le volume molaire de l’eau ?
volume molaire la le volume occupé par une mole d’une substance à STP . Depuis chez STP l’eau occupe très près de 1 cc par gramme, et depuis 1 mole de l’eau molécules pèse très près de 18 grammes, le volume molaire d’eau est d’environ 18 cc.
Comment calculer la concentration molaire ?
Définir Concentration molaire
Le concentration molaire d’une solution est le nombre de moles de soluté divisé par les litres d’eau de la solution. Vous mesurez concentration molaire en moles par litre. Une mole de soluté dans un litre d’eau donne une concentration de 1M.
Qu’est-ce qu’une quantité molaire ?
Quantité molaire – Il est souvent commode d’exprimer une large quantité (par exemple, le volume , enthalpie, capacité calorifique, etc.) comme la valeur réelle divisée par la quantité de substance (nombre de moles). La résultante quantité est appelé volume molaire , molaire enthalpie, etc…
Qu’est-ce que Z en thermodynamique ?
Le facteur de compressibilité ( Z ), également appelé facteur de compression ou facteur de déviation du gaz, est un facteur de correction qui décrit la déviation d’un gaz réel par rapport au comportement d’un gaz idéal. C’est un utile thermodynamique propriété de modifier la loi des gaz parfaits pour tenir compte du comportement réel des gaz.
Qu’est-ce que r dans pV nRT ?
La loi des gaz parfaits est : pV = nRT où n est le nombre de moles, et R est la constante universelle des gaz. La valeur de R dépend des unités impliquées, mais est généralement indiqué avec des unités SI comme suit : R = 8,314 J/mol·K.
Qu’est-ce que la masse molaire en chimie ?
Le masse molaire est le Masse d’un donné chimique élément ou chimique composé (g) divisé par la quantité de substance (mol). Le masse molaire d’un composé peut être calculé en ajoutant le standard atomique masses (en g/mol) des atomes constitutifs.
Quel est le volume molaire de co2 ?
Le le volume d’une mole de CO2 produit est de 24 dm^3 à température et pression ambiantes. Alternativement, si votre réaction a eu lieu à température et pression standard (273 K, 1 atm), alors le volume molaire est de 22,4 dm^3.
Quelle est la valeur de R ?
Le valeur de la constante des gaz ‘ R ‘ dépend des unités utilisées pour la pression, le volume et la température. R = 0,0821 litre·atm/mol·K. R = 8,3145 J/mol·K. R = 8,2057 mètres3·atm/mol·K. R = 62,3637 L·Torr/mol·K ou L·mmHg/mol·K.
Comment s’appelle le PV nRT ?
PV = nRT : La loi des gaz parfaits. Quinze exemples
Chaque unité apparaît trois fois et la racine cubique donne L-atm / mol-K, les unités correctes pour R lorsqu’elles sont utilisées dans un contexte de loi des gaz. En conséquence, nous avons : PV / nT = R. ou, plus communément : PV = nRT . R est appelé la constante des gaz.
Pourquoi le volume molaire est-il le même pour tous les gaz ?
La loi d’Avogadro stipule que « l’égalité volumes de tous les gaz au même température et pression, avoir le même nombre de molécules. » Pour une masse donnée d’un idéal gaz la le volume et la quantité (moles) de gaz sont directement proportionnels si la température et la pression sont constantes.
Qu’est-ce que le STP en chimie ?
STP en chimie est l’abréviation de Standard Temperature and Pressure. STP est le plus souvent utilisé lors de calculs sur des gaz, tels que la densité de gaz. La température standard est de 273 K (0° Celsius ou 32° Fahrenheit) et la pression standard est de 1 atm.
Quel est le volume de gaz au NTP ?
On sait aussi que le volume occupé par 1 mole de gaz chez NTP vaut 22,4 L. En substituant P=1 atm, T=293 K, R=0,0821 L atm K−1 mol−1, on obtient V=24,05 L comme molaire le volume .
Qu’est-ce qu’une mole de gaz ?
UN Môle (en abrégé mol) d’une substance pure est une masse du matériau en grammes qui est numériquement égale à la masse moléculaire en unités de masse atomique (amu). Une Môle d’un idéal gaz occupera un volume de 22,4 litres à STP (Température et Pression Standard, 0°C et une atmosphère de pression).
Qu’est-ce qui affecte le volume molaire?
Volume molaire . Le volume molaire symbole Vmest le le volume occupé par une mole d’une substance (élément chimique ou composé chimique) à une température et une pression données. Il est égal au molaire masse (M) divisée par la masse volumique (ρ).
Quel est le volume molaire de gaz à STP ?
L’exemple le plus courant est le volume molaire d’un gaz à STP (Température et pression standard), qui est égal à 22,4 L pour 1 mole de tout idéal gaz à une température égale à 273,15 K et une pression égale à 1,00 atm.
Qu’est-ce que les unités de volume molaire ?
Le volume molaire (symbole Vm) d’une substance est le le volume occupé par une mole de la substance à une température et une pression données. [1] Il est égal à la masse moléculaire (M) de la substance divisée par sa densité (ρ) à la température et à la pression données : Il a un SI unité de mètres cubes par mole (m3/mol).