Qu’est-ce que l’hypothèse d’avogadro en chimie ?
L’hypothèse d’Avogadro affirme que deux échantillons de gaz de volume égal, à la même température et à la même pression, contiennent le même nombre de molécules. L’hypothèse d’Avogadro permet aux chimistes de prédire le comportement des gaz idéaux. Amedeo Avogadro a fait l’ hypothèse en 1811 dans un essai soumis au Journal de Physique.
Il faut aussi savoir, ce qui soutient l’hypothèse d’Avogadro ?
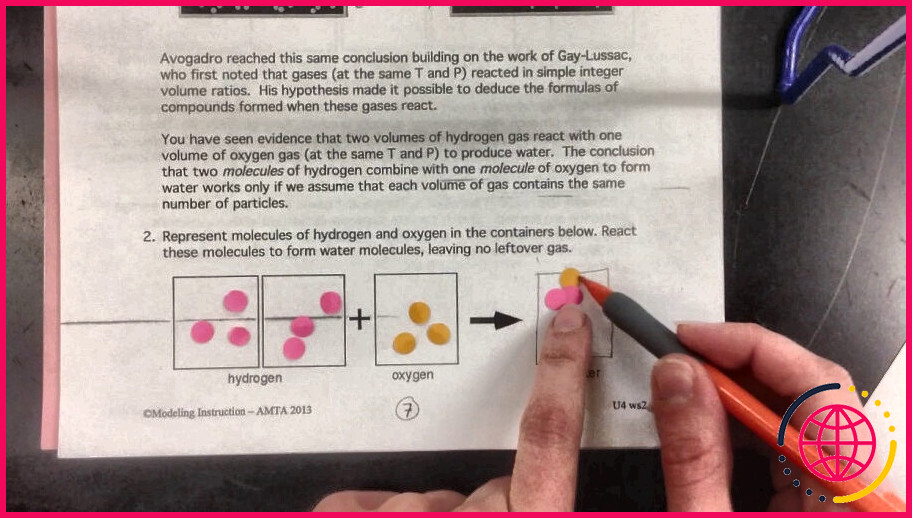
Le comportement observé lorsque certains gaz se combinent. Par exemple, lorsque 2 volumes d’hydrogène se combinent avec 1 volume d’oxygène, il se forme 2 volumes de vapeur d’eau.
De même, qu’est-ce que la loi d’Avogadro et pourquoi est-elle significative ? La loi d’Avogadro étudie la relation entre la quantité de gaz (n) et le volume (v). C’est une relation directe, ce qui signifie que le volume d’un gaz est directement proportionnel au nombre de moles de l’échantillon de gaz présent.
De même on peut se demander quelle est la formule de la loi d’Avogadro ?
Formule de la loi d’Avogadro où ‘V’ est le volume du gaz, ‘n’ est la quantité de gaz (nombre de moles du gaz) et ‘k’ est une constante pour une pression et une température données. En fait, la Loi d’Avogadro , l’hypothèse posée par lui, faisait partie des lois sur lesquelles se base la Loi des gaz idéaux .
Qu’est-ce que le nombre d’Avogadro en chimie ?
Le nombre d’Avogadro , nombre d’unités dans une mole de toute substance (définie comme son poids moléculaire en grammes), égal à 6,02214076 × 1023. Les unités peuvent être des électrons, des atomes, des ions ou des molécules, selon la nature de la substance et le caractère de la réaction (le cas échéant).
Combien de moles y a-t-il dans un gramme ?
Nous supposons que vous convertissez entre moles En et gramme . Vous pouvez consulter plus de détails sur chaque unité de mesure : poids moléculaire de In ou grammes L’unité de base SI pour la quantité de substance est la mole . 1 mole est égale à 1 moles In, ou 114,818 grammes .
Pourquoi l’hypothèse d’Avogadro est-elle importante ?
L’Hypothèse d’Avogadro Il a dit que la meilleure explication des observations de Gay-Lussac sur les réactions des gaz était que des volumes égaux de tous les gaz à la même température et à la même pression contiennent un nombre égal de molécules. Avogadro s’est rendu compte que les éléments pouvaient exister sous la forme de molécules dont les atomes individuels étaient réunis.
Que dit la loi d’Avogadro ?
La loi d’Avogadro (parfois appelée Hypothèse d’Avogadro ou Principe d’Avogadro ) est une loi expérimentale sur les gaz reliant le volume d’un gaz à la quantité de substance de gaz présente. La loi d’Avogadro stipule que « des volumes égaux de tous les gaz, à la même température et à la même pression, ont le même nombre de molécules »
.
L’hypothèse d’Avogadro est-elle correcte ?
Amedeo Avogadro. En 1811, Avogadro a émis une hypothèse qui a été négligée par ses contemporains pendant des années. Finalement prouvée correcte , cette hypothèse est devenue connue sous le nom de Loi d’Avogadro , une loi fondamentale des gaz. Avogadro, cependant, y voyait la clé d’une meilleure compréhension de la constitution des molécules.
Qu’y a-t-il dans une mole ?
Une mole est le poids atomique d’une molécule du produit chimique en grammes. Ainsi, une mole d’une molécule comme l’hydrogène (H) dont le poids atomique est de 1 correspond à un gramme. Mais même si le poids est différent, les deux moles contiennent exactement le même nombre de molécules, 6,02 x 10 à la 23e puissance.
Qui a découvert la mole ?
Amadeo Avogadro
Comment la mole est-elle utilisée en chimie ?
La mole est l’unité de quantité en chimie . Elle constitue un pont entre l’atome et les quantités macroscopiques de matière avec lesquelles nous travaillons en laboratoire. Elle permet au chimiste de peser des quantités de deux substances, disons du fer et du soufre, de façon à obtenir un nombre égal d’atomes de fer et de soufre.
Quel est le volume d’une mole de gaz ?
Une mole d’un gaz idéal occupera un volume de 22,4 litres à la STP (température et pression standard, 0°C et une pression atmosphérique).
Quelle est la formule de la loi de Lussac ?
Gay- La loi de Lussac est une forme de la loi des gaz idéaux dans laquelle le volume du gaz est maintenu constant. Lorsque le volume est maintenu constant, la pression d’un gaz est directement proportionnelle à sa température. Les équations habituelles de la loi de Gay- Lussac sont P/T = constante ou Pi/Ti = Pf/Tf.
Quel est un exemple de la loi d’Avogadro ?
La loi d’Avogadro
stipule que le volume d’un gaz est directement proportionnel au nombre de moles de gaz. Voici quelques exemples . Lorsque vous faites exploser un ballon de basket, vous y faites entrer de force plus de molécules de gaz. Plus il y a de molécules, plus le volume est grand. Les deux ballons contiennent le même nombre de molécules.
Quelle est la valeur de R ?
La valeur de la constante des gaz ‘ R ‘ dépend des unités utilisées pour la pression, le volume et la température. R = 0,0821 litre-atm/mol-K. R = 8,3145 J/mol-K. R = 8,2057 m3-atm/mol-K. R = 62,3637 L-Torr/mol-K ou L-mmHg/mol-K.
Qu’est-ce que p1v1 t1 p2v2 t2 ?
L’équation générale des gaz, à savoir : i. P1V1 / T1 = P2V2 / T2 . ii. Remarque : la température (T) est exprimée en degrés absolus.
Quelle est la valeur de r dans pV nRT ?
La loi des gaz idéaux est : pV = nRT , où n est le nombre de moles, et R est la constante universelle des gaz. La valeur de R dépend des unités concernées, mais elle est généralement énoncée avec les unités S.I. comme suit : R = 8,314 J/mol-K.
Comment calculer les moles ?
Utiliser la formule moléculaire pour trouver la masse molaire ; pour obtenir le nombre de moles , diviser la masse du composé par la masse molaire du composé exprimée en grammes.
Combien de molécules y a-t-il dans une mole ?
Le nombre d’Avogadro est une relation très importante à retenir : 1 mole = 6,022×1023 6,022 × 10 23 atomes, molécules , protons, etc. Pour convertir des moles en atomes, multipliez la quantité molaire par le nombre d’Avogadro. Pour convertir des atomes en moles , divisez la quantité atomique par le nombre d’Avogadro (ou multipliez par son inverse).
Qui a découvert la loi d’Avogadro ?
Amedeo Avogadro
Comment appelle-t-on PV nRT ?
PV = nRT : La loi des gaz parfaits. Quinze exemples Chaque unité apparaît trois fois et la racine cubique donne L-atm / mol-K, les unités correctes pour R lorsqu’elles sont utilisées dans un contexte de loi des gaz. Par conséquent, nous avons : PV / nT = R. ou, plus communément : PV = nRT . R est appelé la constante des gaz.