Qu’est-ce qu’un modèle d’ajustement induit ?
Le Modèle d’ajustement induit – Le modèle d’ajustement induit stipule que le substrat agit comme une « clé » sur la « serrure » du site actif. Cette théorie soutient que le site actif et le substrat ne sont pas, au départ, parfaitement adaptés l’un à l’autre. Le substrat induit plutôt un changement de forme dans l’enzyme.
De même, vous pouvez vous demander ce qu’est un ajustement induit ?
Lorsqu’une enzyme se lie au substrat approprié, des changements subtils dans le site actif se produisent. Cette altération du site actif est connue sous le nom d’un ajustement induit . L’ajustement induit améliore la catalyse, car l’enzyme convertit le substrat en produit.
De même, qu’est-ce que la théorie de l’ajustement induit en biologie ? …la base de ce qu’on appelle la théorie de l’ajustement induit – , qui stipule que la liaison d’un substrat ou d’une autre molécule à une enzyme provoque un changement de forme de l’enzyme de façon à améliorer ou à inhiber son activité.
De même, les gens se demandent pourquoi le modèle d’ajustement induit est meilleur ?
La théorie de l’ajustement induit est la plus largement acceptée et utilisée. L’ajustement induit est le plus accepté parce qu’il a été un développement du mécanisme de la serrure et de la clé car il suggère que le site actif de l’enzyme change légèrement pour que le substrat puisse s’adapter , alors que la serrure et la clé ne disent rien sur le changement du site actif.
En quoi le modèle de l’ajustement induit est-il différent du lock and key ?
Lock and Key affirme qu’il n’y a pas de changement nécessaire et que seul un certain type va fit . Cependant induced fit dit que le site actif va changer pour aider au substrat fit . Dans lock and key le site actif a une seule entrée alors que dans induced fit le site actif est constitué de deux composants.
Que se passe-t-il dans le modèle d’ajustement induit ?
Le induced fit model décrit la formation du complexe E-S comme résultat de l’interaction entre le substrat et un site actif flexible. Le substrat produit des changements de conformation sur l’enzyme en alignant correctement les groupes de l’enzyme. Cela permet une meilleure liaison et des effets catalytiques.
Quels sont les 4 facteurs qui peuvent réguler l’activité des enzymes ?
Plusieurs facteurs affectent la vitesse à laquelle les réactions enzymatiques se déroulent – température , pH, concentration de l’enzyme , concentration du substrat , et présence d’éventuels inhibiteurs ou activateurs.
Qu’est-ce qui détermine la spécificité d’une enzyme ?
La spécificité d’une enzyme désigne sa capacité à agir sélectivement sur une substance ou un petit nombre de substances chimiquement similaires, les substrats de l’ enzyme . Comme la spécificité des anticorps, la spécificité de l’ enzyme dépend d’un ajustement étroit entre les molécules de substrat et leurs sites de liaison sur un enzyme .
Comment la température affecte-t-elle l’ajustement induit ?
L’augmentation de la température augmente généralement la vitesse d’une réaction, mais des changements spectaculaires de température et de pH peuvent dénaturer une enzyme, abolissant ainsi son action en tant que catalyseur. Le modèle de l’ adaptation induite stipule qu’un substrat se lie à un site actif et que les deux changent légèrement de forme, créant un adaptation idéale pour la catalyse.
Comment le site actif de la Toothpickase correspond-il au concept d’ajustement induit ?
Le concept d’ajustement dit qu’il y a un changement dans la forme du site actif d’une enzyme pour qu’il se lie plus étroitement au substrat, induit par l’entrée du substrat. Répétez l’activité comme indiqué, sauf en changeant la variable ci-dessus.
Qu’est-ce que le docking à ajustement induit ?
1.1 Docking par ajustement induit Applications Ces changements permettent au récepteur de modifier son site de liaison afin qu’il se conforme plus étroitement à la forme et au mode de liaison du ligand. Ce phénomène est souvent appelé » adaptation induite » et constitue l’un des principaux facteurs de complication de la conception de médicaments basée sur la structure.
Comment les enzymes sont-elles activées ?
Les enzymes sont des protéines qui catalysent des réactions dans les cellules. Certaines enzymes doivent être activées pour pouvoir fonctionner. Les activateurs sont des effecteurs qui se lient à un site allostérique et aident le substrat à se fixer. Les cofacteurs peuvent également être nécessaires pour activer une enzyme ; ils aident le substrat à s’insérer dans le site actif .
Comment l’ajustement induit diminue-t-il l’énergie d’activation ?
La baisse de l’énergie d’activation d’une réaction, plus la vitesse est rapide. Ainsi, les enzymes accélèrent les réactions en abaissant l’énergie d’activation . Ceci est appelé « ajustement induit « , ce qui signifie que l’orientation précise de l’enzyme requise pour l’activité catalytique peut être induite .
par la liaison du substrat.
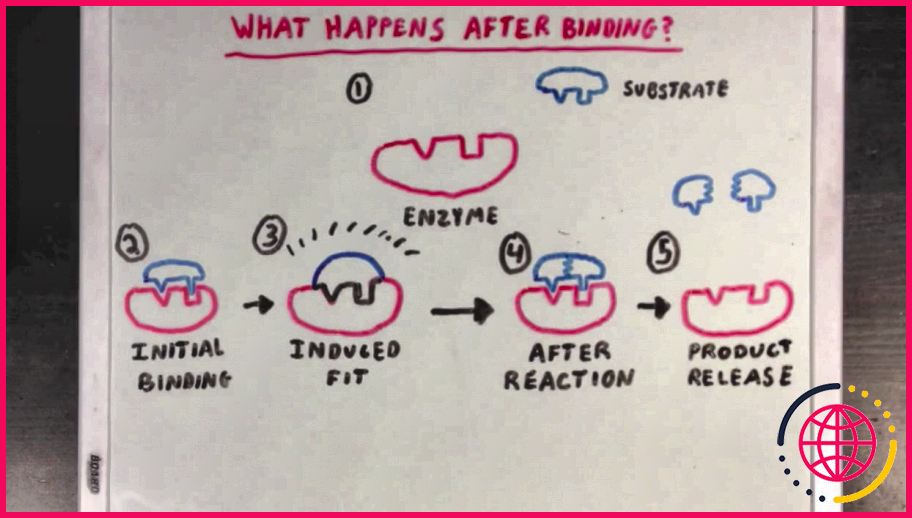
Quelles sont les 4 étapes du fonctionnement des enzymes ?
Quatre étapes de l’action des enzymes
- L’enzyme et le substrat sont dans la même zone. Dans certaines situations, il y a plus d’une molécule de substrat que l’enzyme va modifier.
- L’enzyme s’accroche au substrat dans une zone spéciale appelée site actif.
- Un processus appelé catalyse se produit.
- L’enzyme relâche le produit.
Comment le pH affecte-t-il l’activité des enzymes ?
Les enzymes sont affectées par les changements de pH . La valeur de pH la plus favorable – le point où l’ enzyme est la plus active – est appelée pH optimale. Des valeurs de pH extrêmement élevées ou basses entraînent généralement une perte totale de activité pour la plupart des enzymes . Le pH est également un facteur de stabilité des enzymes .
Quels sont les avantages des complexes multi-enzymes ?
Un autre avantage métabolique des complexes multienzymes , de façon similaire à ce qui se passe avec les enzymes multifonctionnelles, est qu’ils permettent de contrôler de façon coordonnée l’activité catalytique des enzymes qui les composent.
Comment fonctionnent les cofacteurs et les coenzymes ?
Coenzymes & ; Cofacteurs . Coenzymes et cofacteurs sont des molécules qui aident une enzyme ou une protéine à fonctionner correctement. Les coenzymes sont des molécules organiques et se lient assez souvent de manière lâche au site actif d’une enzyme et aident au recrutement du substrat, alors que les cofacteurs ne se lient pas à l’enzyme.
En quoi les enzymes et les catalyseurs sont-ils différents ?
Les catalyseurs sont des substances qui augmentent ou diminuent la vitesse d’une réaction chimique mais qui restent inchangées. Les enzymes sont des protéines qui augmentent la vitesse des réactions chimiques en convertissant le substrat en produit.
De quelles manières les catalyseurs enzymatiques augmentent-ils la vitesse des réactions ?
De quelles manières les catalyseurs enzymatiques augmentent-ils les taux de réactions ? Ils abaissent l’énergie d’activation de la réaction . Ils déplacent l’équilibre de la réaction vers les produits Ils augmentent la concentration des réactifs. Ils diminuent l’énergie libre de la réaction Ils favorisent la formation d’un état de transition.
Quelle est la méthode utilisée pour nommer les enzymes ?
On nomme les enzymes en ajoutant le suffixe -ase au nom du substrat qu’elles modifient (ex : uréase et tyrosinase), ou au type de réaction qu’elles catalysent (déshydrogénase, décarboxylase).
Comment les enzymes accélèrent-elles les réactions ?
Comme tous les catalyseurs, les enzymes agissent en diminuant l’énergie d’activation des réactions chimiques. L’énergie d’activation est l’énergie nécessaire pour démarrer une réaction chimique. De l’énergie est également libérée au cours de la réaction . L’ enzyme accélère la réaction en diminuant l’énergie d’activation nécessaire au démarrage de la réaction .
Pourquoi le modèle d’ajustement induit a-t-il remplacé la serrure et la clé ?
Leurs formes complémentaires les font s’emboîter parfaitement l’une dans l’autre comme un serrure et une clé . Cette théorie a été remplacée par le modèle d’ajustement induit qui prend en compte la flexibilité des enzymes et l’influence que le substrat a sur la forme de l’enzyme afin de former un bon ajustement .