Qu’est-ce qu’une formule relative ?
La masse de la formule relative d’un composé est calculée en additionnant les valeurs de la masse atomique relative de tous les atomes de sa formule . Les moles sont des unités utilisées pour mesurer la quantité de substance.
Alors, quelle est la formule de la masse relative ?
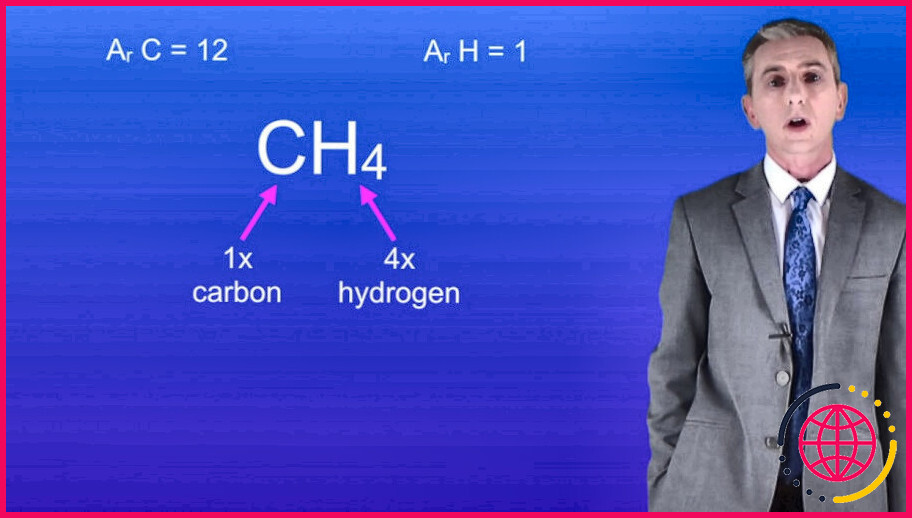
Masse relative moléculaire Par exemple, l’eau a la formule chimique H2O, il y a donc deux atomes d’hydrogène et un atome d’oxygène. Calculez la masse moléculaire relative en multipliant la masse atomique relative de chaque atome par le nombre de ces atomes dans la molécule, puis en additionnant les résultats.
De plus, la masse atomique relative est-elle la même que la masse relative de formule ? La masse relative de formule utilise le même symbole que la masse moléculaire relative (Mr) et est égale à la somme des masses atomiques relatives des atomes dans une unité de formule du composé.
A côté de ce qui précède, qu’est-ce qu’un nombre relatif en chimie ?
Le nombre relatif d’atomes est la formule empirique. Le nombre relatif d’atomes. Un composé est constitué de deux ou plusieurs atomes réunis dans un rapport fixe. Par exemple, dans l’eau, H2O , le nombre relatif d’atomes d’hydrogène et d’oxygène est H:O. =1:2 .
Comment calcule-t-on l’AR ?
La formule et le calcul
- Ajouter la valeur des comptes à recevoir au début de la période souhaitée à la valeur à la fin de la période et diviser la somme par deux.
- Diviser la valeur des ventes à crédit nettes de la période par la moyenne des comptes débiteurs au cours de la même période.
Quelle est la masse relative de la formule du HCL ?
Réponse et explication : La masse molaire de l’acide chlorhydrique est 36,46 g/mol.
Comment trouver l’abondance relative ?
Comment calculer l’abondance en pourcentage d’un isotope
- .
Étape 1 : trouver la masse atomique moyenne. Identifiez la masse atomique de l’élément de votre problème d’abondance isotopique sur le tableau périodique.
- Étape 2 : préparez le problème d’abondance relative.
- Étape 3 : Résolvez pour x pour obtenir l’abondance relative de l’isotope inconnu.
- Étape 4 : trouver l’abondance en pourcentage.
Qu’est-ce que la masse relative en chimie ?
Une masse atomique relative (également appelée poids atomique ; symbole : Ar) est une mesure du poids des atomes. C’est le rapport entre la masse moyenne par atome d’un élément d’un échantillon donné et 1/12 de la masse d’un atome de carbone 12. Un atome d’un élément possédant un certain nombre de neutrons est appelé un isotope.
Qu’est-ce que la charge relative ?
On peut dire que ce sont des valeurs absolues de charge . Cependant, pour simplifier les choses si on dit qu’un électron a -1 unité de charge alors le proton aura +1 unité de charge . Ces nombres sont alors appelés charges relatives où -1 est équivalent à -1,602 x 10^-19 Coulomb.
Comment détermine-t-on la concentration ?
La formule standard est C = m/V, où C est la concentration , m est la masse du soluté dissous, et V est le volume total de la solution. Si vous avez une petite concentration , trouvez la réponse en parties par million (ppm) pour que ce soit plus facile à suivre.
Comment trouver la formule empirique ?
- Commencez par le nombre de grammes de chaque élément, donné dans le problème.
- Convertissez la masse de chaque élément en moles en utilisant la masse molaire du tableau périodique.
- Divisez chaque valeur molaire par le plus petit nombre de moles calculé.
- Arrondissez au nombre entier le plus proche. Ceci est le rapport molaire des éléments et est.
Est-ce que AR et MR sont identiques ?
(6) Pour les molécules, Mr est la masse moléculaire relative ou le poids moléculaire ; pour les atomes, Mr est la masse atomique relative ou le poids atomique et le symbole Ar peut être utilisé. Mr peut également être appelée la masse molaire relative, Mr ,B = MB/Mθ, où Mθ = 1 g mol-1.
Comment trouver la formule moléculaire ?
Divisez la masse molaire du composé par la masse molaire de la formule empirique. Le résultat doit être un nombre entier ou très proche d’un nombre entier. Multipliez tous les indices de la formule empirique par le nombre entier trouvé à l’étape 2. Le résultat est la formule moléculaire .
Qu’est-ce qu’un nombre relatif ?
Les nombres relatifs ou valeurs dépendent d’autres nombres . En d’autres termes, ils sont relatifs à d’autres nombres (absolus). Le plus souvent, ces autres nombres absolus… ne sont même pas données. Par exemple, 2 voitures sur 5 roulent trop vite sur une route.
Qu’est-ce que le numéro de masse atomique ?
Le nombre de masse (symbole A, du mot allemand Atomgewicht [ atomic weight]), également appelé nombre de masse atomique ou nombre de nucléons, est le nombre total de protons et de neutrons (appelés ensemble nucléons) dans un noyau atomique . Le nombre de masse est différent pour chaque isotope différent d’un élément chimique.
Qu’entendez-vous par atomicité ?
L’atomicité est le nombre total d’atomes présents dans une molécule d’un élément, d’un composé ou d’une substance.
Qu’y a-t-il dans une mole ?
Une mole est le poids atomique d’une molécule du produit chimique en grammes. Ainsi, une mole d’une molécule comme l’hydrogène (H) dont le poids atomique est de 1 correspond à un gramme. Mais même si le poids est différent, les deux moles contiennent exactement le même nombre de molécules, 6,02 x 10 à la 23e puissance.
Qu’est-ce que l’abondance relative des isotopes ?
Les atomes qui ont le même nombre de protons mais un nombre différent de neutrons sont appelés isotopes . Les Isotopes ont des masses atomiques différentes. L’ abondance relative d’un isotope est le pourcentage d’atomes ayant une masse atomique spécifique trouvés dans un échantillon naturel d’un élément.
Qu’est-ce que l’AR en chimie ?
L’argon est un élément chimique avec le symbole Ar et le numéro atomique 18. Il fait partie du groupe 18 du tableau périodique et est un gaz noble. L’argon est le troisième gaz le plus abondant dans l’atmosphère terrestre, à 0,934 % (9340 ppmv).
Comment calculer les moles ?
Utilisez la formule moléculaire pour trouver la masse molaire ; pour obtenir le nombre de moles , divisez la masse du composé par la masse molaire du composé exprimée en grammes.
Qu’est-ce que la mole relative ?
Masse moléculaire relative et moles . Moles , masse moléculaire relative et composés. 1 mole de tout composé a une masse égale à la masse moléculaire relative de ce composé exprimée en grammes. N’oubliez pas qu’une mole n’est qu’un autre nom pour un nombre d’Avogadro de particules de cette substance – 6,02 x 1023. Exemple : l’eau H
Comment les atomes existent-ils ?
Les atomes existent à l’état libre sous forme de molécule. Les molécules peuvent être formées par la combinaison de atomes de deux ou plusieurs éléments différents. Par exemple, la molécule d’eau. Elle est formée par la combinaison de deux atomes d’hydrogène et d’un atome d’oxygène.